נבג בסיס מכתים, טכניקות ושימושים
ה מכתים נבג היא המתודולוגיה המשמשת לצבוע את מבני ההתנגדות היוצרים כמה סוגים של חיידקים כאשר הם במצב שלילי; מבנים אלה תואמים את דרך ההישרדות.
יש גנרלים רבים שנוצרים נבגים; עם זאת, העיקריים הם Bacillus ו Clostridium. גנרלים אלה נחשבים רלוונטיים יותר משום שיש להם מינים פתוגניים לבני אדם.
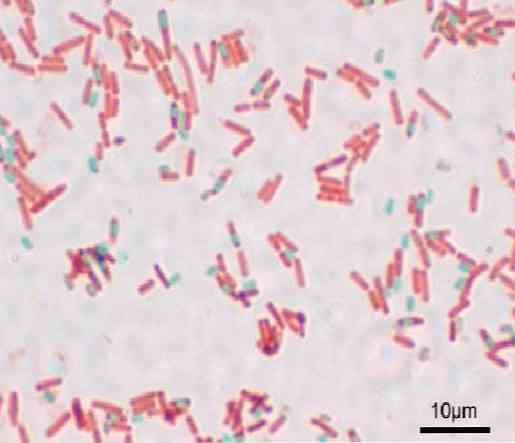
כל bacillus יכול להוליד נבג. בזמן צביעה ההכנה, נבג ניתן למצוא בתוך bacillus (endospore) או מחוצה לו (exospore). עם שיטות קונבנציונאלי מכתים עבור חיידקים - כגון כתם גרם - נבגים להישאר חסר צבע.
כיום, יש כמה מתודולוגיות צביעה כי הם מסוגלים לחצות את המבנה העבה של נבג לצבוע אותו. מתודולוגיות אלו הן מגוונות מאוד; בין אלה אנו יכולים להזכיר את הטכניקה דורנר, את הכתם מולר ואת המתודולוגיה שאפר- Fulton, הידוע גם בשם Wirtz-Conklin..
מבין כל הטכניקות שהוזכרו, מתודולוגיית שאפר-פולטון היא המעבדה השגרתית ביותר. היא חייבת את שמה לשני מיקרוביולוגים שיצרו את הצבע ב -1930: אלישיה שפר ומקדונלד פולטון. עם זאת, לפעמים הטכניקה נקראת Wirtz-Conklin לכבוד שני בקטריולוגים של 1900.
אינדקס
- 1 קרן
- 2 טכניקות צביעה של נבגים
- 2.1 הטכניקה של דורנר
- 2.2 שינוי טכניקת דורנר
- 2.3 טכניקה של שפר-פולטון או וירץ-קונקלין
- 2.4 טכניקה Möeller
- 2.5 שינוי טכניקה Möeller ללא חום
- 3 שימושים
- 3.1 דוגמאות
- 4 הפניות
קרן
הנבגים אינם כתמים עם צבעים קונבנציונליים כי יש להם קיר עבה מאוד. הרכב מורכב של נבגים מונע את כניסתם של רוב הצבעים.
אם נבגים נלמדים מן החוץ אל פנים, שכבות הבאות הם נצפו: ראשית, exosporium, המהווה את השכבה החיצונית הדק שנוצר על ידי גליקופרוטאינים..
ואז מגיע לציפורן, אשר מספק עמידות לטמפרטורות גבוהות, ואחריו קליפת המורכבת של peptidoglycan. אז יש את הקיר של הבסיס אשר מגן על protoplast.
נבג הוא מבנה מיובש המכיל 15% סידן וחומצה dipicolinic. לכן, רוב טכניקות צביעה נבג מבוססים על יישום של חום, כך צבע יכול לחדור את המבנה העבה.
לאחר כתם נבג, היא אינה מסוגלת להסיר את צבען. בטכניקה שייפר-פולטון ירוק מלכיט נכנס לתאים צמחיים, על ידי הפעלת חום, חודר endospore וגם exosporas.
כאשר כביסה עם מים, צבע מוסר מן התא הגטטיבי. זה קורה כי צבע מלכיט ירוק הוא קצת בסיסי, ולכן הוא נקשר חלש לתא הגטטיבי.
מצד שני, זה לא יכול לצאת מן הנבגים ולבסוף את bacillus עם safranin הוא בניגוד. בסיס זה תקף עבור שאר הטכניקות, שבהן משהו דומה קורה.
טכניקות צביעה של נבגים
כדי להפוך את כתם נבגים, אתה חייב להיות תרבות טהורה של המתח החשוד כי אתה רוצה ללמוד.
התרבות נתון לטמפרטורות קיצוניות במשך 24 שעות כדי לעורר את המיקרואורגניזם כדי sporulate. לשם כך, התרבות ניתן להציב בתנור על 44 מעלות צלזיוס או במקרר (8 מעלות צלזיוס) במשך 24 או 48 שעות.
אם נשאר יותר מדי זמן בטמפרטורות שהוזכרו, רק exospores יהיה ציין, שכן כל endospores ישארו את bacillus.
בסופו של דבר, כמה טיפות של פתרון פיזיולוגי סטרילי צריך להיות ממוקם על שקופית נקייה. אז חלק קטן של היבול הוא נלקח והפצה בסדר עשוי.
לאחר מכן הוא נותר יבש, הוא קבוע לחום והוא מוכתם עם כמה טכניקות מוסברים להלן:
הטכניקה של דורנר
1 - היכונו במבחנה ההשעיה מרוכזת של מיקרואורגניזם ספורציה במים מזוקקים ולהוסיף נפח שווה של מסנן פוקסין Kinyoun מסוננים.
2. מניחים את הצינור באמבטיה עם מים רותחים במשך 5 עד 10 דקות.
3 על שקופית נקייה, מערבבים טיפה של ההשעיה הקודמת עם ירידה של 10% פתרון nigrosine מימית, מבושל ומסונן.
4. הרחבת ויבש במהירות עם חום קל.
5. בחינה עם המטרה 100X (טבילה).
הנבגים כתמים אדומים ותאי החיידקים מופיעים כמעט חסרי צבע על רקע אפור כהה.
טכניקת דורנר שונה
1 - השעיית המיקרואורגניזם המקוטע מתפשטת בשקופית ומוקפת לחום.
2 - המדגם מכוסה ברצועת נייר סינון שאליו הוא הוסיף fuchsin חומצה fenicin. צבע מחומם במשך 5 עד 7 דקות עם הלהבה של מבער Bunsen עד שחרורו של האדים נוצרת. לאחר מכן, הנייר יוסר.
3. שטפו את ההכנה במים ולאחר מכן יבש עם נייר סופג.
4 - לכסות את המריחה עם סרט דק של 10% nigrosin, באמצעות שקופית השנייה להפיץ את nigrosin או מחט.
הצבעים שנלקחו על ידי נבגים וחיידקים זהים לאלה המתוארים באמנות הקודמת.
שיפר-פולטון או טכניקת וירץ-קונקלין
1 - הפוך רזה להתפשט עם השעיה של מיקרואורגניזם sporulated על שקופית ולתקן אותו לחום.
2. לכסות את השקופית עם תמיסה מימית של ירוק 5% מלכיט (נייר סינון ניתן למקם על הסדין).
3. מחממים על הלהבה של מבער בונזן כדי לגרום לאדים לברוח ולהסיר את הלהבה. חזור על הפעולה במשך 6 עד 10 דקות. אם במהלך ההליך הפתרון הירוק מלכיט מתאדה יותר מדי, יותר ניתן להוסיף.
.4 הסר את נייר הסינון (אם הוא הונח) ושטוף במים.
5 כיסוי שקופיות עם safranin מהימי 0.5% עבור 30 שניות (גרסות מסוימות של הטכניקה באמצעות 0.1% safranin המימי ולהשאיר למשך 3 דקות).
עם טכניקה זו הנבגים הם ירוקים bacilli הם אדומים.
יש לו את החיסרון כי endospores של תרבויות צעירים לא כתם טוב, שכן הם נראים ברורים מאוד או חסר צבע. כדי למנוע זאת, מומלץ להשתמש בתרבויות של 48 שעות של הדגירה.
Möeller טכניקה
1 - מכסים את המריחה עם כלורופורם למשך 2 דקות.
2 - מחק את כלורופורם.
3- מכסים בחומצה כרומית של 5% למשך 5 דקות.
4. לשטוף עם מים מזוקקים
5. הסדין מכוסה קרפיון פוצ'ין-פנולי וחשוף ללהבה של מבער בונזן עד פליטת האדים; ואז הוא מוסר מן הלהבה לכמה רגעים. המבצע חוזר על עצמו עד שהוא מגיע ל -10 דקות.
6. לשטוף עם מים.
7. השתמש אתנול חומצי (אלכוהול הידרוכלורי) כדי decolorize. זה נשאר 20 או 30 שניות.
8 - לשטוף עם מים מזוקקים.
9 - Counteract מכסה את הסדין עם מתילן כחול במשך 5 דקות.
10 - שטפו במים מזוקקים.
11 - זה נותר להתייבש המדגם נלקח תחת מיקרוסקופ.
נבגים נראים bacilli אדום וכחול. חשוב לא לשאוף את האדים, כי הם רעילים בטווח הארוך הם יכולים להיות מסרטנים.
השתנה טכניקה Möeller ללא חום
בשנת 2007 Hayama ועמיתיו יצרו שינוי של הטכניקה מולר. הם ביטלו את השלב של חימום צבע והוחלף על ידי תוספת של 2 טיפות של סורפקטנט Tergitol 7 לכל 10 מ"ל של carbol פתרון carbol fuchsin. אותן תוצאות הושגו.
שימושים
צביעת נבגים ספק מאוד יקר ושימושי עבור מידע זיהוי פתוגן, מאז הנוכחות של אותו, צורה, מיקום בתוך החיידק ואת היכולת לעוות את התא וגטטיבי או לא, הם נתונים שיכולים להנחות על המינים בתוך מין מסוים.
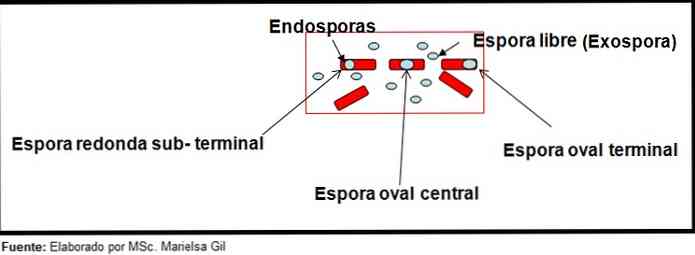
בהקשר זה, ראוי להזכיר כי נבגים יכול להיות עגול או אליפסה, הם יכולים להיות ממוקמים במרכז או גם במצב paracentral, subterminal או מסוף.
דוגמאות
- קלוסטרידיום יוצר נבג סגלגל במצב סופני המעוות את הבצילוס.
- הנבגים של קלוסטרידיום טרטיום זה סגלגל, לא לעוות את bacillus והוא ממוקם ברמת הטרמינל.
- הקצה של קלוסטרידיום טטניה זה מסוף מעוות את bacillus, נותן את המראה של drumstick.
- הנבגים של קלוסטרידיום בוטולינום, ג. histolyticum, ג. טירון ו C. septicum הם עגולים או סוביים אליפטיים ומעוותים את הבצילוס.
- הקצה של קלוסטרידיום סורדלי הוא ממוקם במיקום המרכזי, עם דפורמציה קלה.

הפניות
- Hayama M, אואנה K, Kozakai T, אומדה S, פוג'ימוטו J, אוטה H, הצעת Kawakami י של טכניקה פשוטה עבור מכתים נבגים של חיידקים מבלי להחיל שינוי חום-מוצלח של השיטה של מולר. Eur J Med Res. 2007; 16 12 (8): 356-9.
- תורמים ויקיפדיה. כתם מולר. ויקיפדיה, האנציקלופדיה החופשית. 3 בנובמבר 2018, 03:28 UTC. זמין בכתובת: en.wikipedia.org
- Pérez R, Juárez M, Rodríguez (2011). מדריך מעבדה של טכניקות מיקרוביולוגיות. המחלקה למדעי יסוד האקדמיה למיקרוביולוגיה. המכון הפוליטכני הלאומי.
- "אנדוספורה". ויקיפדיה, האנציקלופדיה החופשית. 25 בפברואר 2018, 10:20 UTC. 10 Jan 2019, 02:42: en.wikipedia.org
- סילבה L, סילבה C, פרננדס N, בואנו C, טורס J, ריקו M, Macías J ומשתפי פעולה. (2006). אנשי כוח אדם של הקהילה האוטונומית של אקסטרמדורה. סדר היום הספציפי הרביעי. עריכה MAD. סביליה-ספרד, עמ '211-212.
- סילבה M, García M, Corrales J, Ponce E. (2006). מומחה טכנאי מעבדה, של שירות הבריאות גליציאנית (SERGAS). נושא משנה נפח ספציפי 2. MAD העריכה. סביליה-ספרד, עמ '79-80.
- Koneman E, אלן S, Janda W, Schreckenberger P, Win W. (2004). אבחון מיקרוביולוגי. (מהד 'ה -5). ארגנטינה, עריכה Panamericana S.A..
- פורבס B, סחם D, Weissfeld A. 2009. אבחון מיקרוביולוגי של ביילי & סקוט. 12 ed. ארגנטינה Panamericana S.A העריכה


