נתרן אוקסיד (Na2O) פורמולה, נכסים, סיכונים
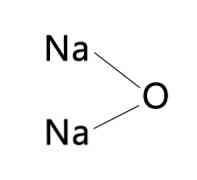
ה נתרן תחמוצת הוא תרכובת אנאורגנית של נוסחה Na2O. כמו כל תחמוצות מתכת אלקלית, יש antifluorite דומה (דומה Fluorspar, CaF2, אבל עם קטיונים ואניונים ההפוכים) המתאימים מבנה הגבישי מרוכז פנים מעוקבים. (נתרן: תחמוצת דיסודיום, 1993-2016).
זה יכול להיות אמר כי תחמוצת הנתרן הוא אנהידריד של נתרן hydroxide, שכן הוא מגיב עם מים כדי ליצור שני שומות של המתחם הזה בדרך הבאה:
Na2O + H2O → 2NaOH
בדרך כלל, שם KNaO ניתן למצוא, בהתייחסו תחמוצת הנתרן או תחמוצת אשלגן. הסיבה לכך היא כי שני תחמוצות יש מאפיינים דומים במונחים של צבע ומהירויות של התרחבות והתכווצות.
מקורות מסיסים לעתים קרובות של תחמוצת הנתרן כוללים עקבות של תחמוצת אשלגן, למשל feldspars (איור 2), שהם המקור העיקרי של נתרן אמייל מסוימים (בריט, 2007).

אינדקס
- תכונות פיסיקליות וכימיות
- 2 תגובה וסיכונים
- 3 שימושים
- 4 הפניות
תכונות פיסיקליות וכימיות
תחמוצת הנתרן הוא מוצק גבישי לבן (איור 3). יש לו משקל מולקולרי של 61.98 גרם / מול, יש צפיפות של 2.27 גרם / מ"ל נקודת התכה של 1275 מעלות צלזיוס.
המתחם יש נקודת רתיחה של C ° 1950 שמתחיל להתפרק כדי חמצן נתרן ומתכת נתרן, לעומת זאת, תכונה מעניינת היא כי תחמוצת נתרן מתחיל לעדן ב 1100 ° C (המרכז הלאומי למידע ביוטכנולוגיה, SF ).

מגיב באלימות עם מים ואלכוהול כדי ליצור hydroxide נתרן. תחמוצת נתרן, Na2או, זה reversibly סופג מימן (H2), כדי ליצור hydride נתרן (NaH) ו hydroxide נתרן (NaOH), אשר יש פוטנציאל למצוא את היישום שלה לאחסון הפיך של מימן.
תגובה וסיכונים
תחמוצת הנתרן היא תרכובת יציבה שאינה דליקה, אך יכולה להגיב באלימות עם חומצות ומים. זה יכול גם להגדיל את הבעירה של חומרים אחרים. זה מסווג כמו קורוזיבי יכול לשרוף את העור ואת העיניים (החברה המלכותית לכימיה, 2015).
הפתרון במים הוא בסיס חזק, שכן הוא מגיב באלימות עם חומצות להיות קורוזיביים. כאשר מגיבים באלימות עם מים, נתרן hydroxide מיוצר, תוקפים מתכות רבות בנוכחות מים.
החומר הוא גם מאכל על דרכי הנשימה ועל בליעה. שאיפת אירוסול עלולה לגרום לבצקת ריאות (המכון הלאומי לבטיחות ובריאות תעסוקתית, 2014).
במקרה של שאיפה, יש להעביר את האדם המושפע למקום קריר. אם הקורבן לא לנשום, הנשמה מלאכותית צריך להינתן. לאחר מכן ללכת או לראות רופא בהקדם האפשרי.
במקרה של מגע עם העור, בגדים מזוהמים ונעליים יש להסיר מיד לרחוץ עם הרבה מים.
במקרה של מגע עם העיניים, יש לשטוף עם הרבה מים במשך 15 דקות לפחות להתייעץ עם רופא. במקרה של בליעה, לא חושב על גורם להקאה, אבל לשטוף את הפה עם מים להתייעץ עם רופא.
הסימפטומים החשובים ביותר והאפקטים יכולים להיות: עוויתות, דלקת ובצקת של הגרון הסמפונות, דלקת ריאות, בצקת ריאות, תחושת צריבה, שיעול, צפצופים, דלקת גרון וקוצר נשימה (תחמוצת נתרן (Na2O) (CAS 1313- 59-3) MSDS, 2010-2017).
הסימפטומים של בצקת ריאות לעתים קרובות אינם באים לידי ביטוי עד לאחר כמה שעות והם מחמירות על ידי מאמץ פיזי. מנוחה ותצפיות רפואיות הן חיוניות.
תחמוצת הנתרן צריך להיות מאוחסן במקום יבש מופרד חומצות חזקות. מאחר שהמתחם מגיב באלימות עם מים, במקרה של שריפה, אין להשתמש במיכלי כיבוי או בממטרות על בסיס מים. מומלץ להשתמש באבקות או בחול יבש.
שימושים
השימוש העיקרי של תחמוצת הנתרן הוא בייצור של זכוכית. הוא משמש קרמיקה כוסות, אם כי לא בצורה גלם. נתרן תחמוצת בדרך כלל מהווה כ 15% של הרכב כימי של זכוכית.
זה מקטין את הטמפרטורה שבה דו תחמוצת הסיליקון נמסה (הרכב זכוכית ב 70%), וכתוצאה מכך זה זול יותר ויעיל יותר לייצר זכוכית, שכן זה דורש הוצאות אנרגיה נמוכה יותר של היצרן (ג 'ורג' סאמנר, SF ).
נתרן-סיד זכוכית הוא הצורה הנפוצה ביותר של הזכוכית המיוצרת, להיות מורכב על 70 סיליקה% (דו תחמוצת צורן), 15% סודה (תחמוצת נתרן) ו 9% סיד (תחמוצת סידן), עם כמויות יותר קטן של תרכובות אחרות.
תחמוצת הנתרן משמשת שטף להנמיך את הטמפרטורה שבה סיליקה נמס, ואת מעשים סיד כמייצב עבור סיליקה. זכוכית סיד לימון הוא זול, יציב מבחינה כימית, קשה למדי, ועביד מאוד, כי הוא מסוגל להיות מרוכך כמה פעמים במידת הצורך.
תכונות אלה הופכות אותו מתאים לייצור מגוון רחב של מוצרי זכוכית, כולל נורות, משקפיים, בקבוקים וחפצי אמנות.
מצד שני, תחמוצת הנתרן וסיליקה מכילה קריסטל מים, המכונה גם נתרן סיליקט או זכוכית מים, אשר יוצר זגוגית מוצק עם המאפיין מאוד שימושי של להיות מסיס במים.
זכוכית מים נמכרת כמו גושים מוצקים או אבקות, או כמו נוזל, ברור סירופ. הוא משמש כמקור נוח של נתרן למוצרים תעשייתיים רבים כבונה ב אבקות כביסה, כמו קלסר דבק, כמו flocculant במתקני טיפול במים רבים יישומים אחרים (האנציקלופדיה בריטניקה, 2017).
תרכובות אוקסיד לא להוביל חשמל. עם זאת, תחמוצות מובנים מסוימים של perovskite הם מוליכים אלקטרוניים ליישום בקתודה של תאים דלק תחמוצת מוצק ומערכות ייצור חמצן (American Elements, 1998-2017).
הפניות
- המכון הלאומי לבטיחות ובריאות תעסוקתית. (2014, 1 יולי). CDC סודיום OXIDE. שוחזר מ- cdc.
- אלמנטים אמריקאיים. (1998-2017). סודיום אוקסיד. שחזר מ americanelements.com.
- Britt, J. (2007). המדריך השלם על אש גבוהה glazes. ניו יורק: ספרי לארק.
- אנציקלופדיה בריטניקה. (2017). נתרן תחמוצת כימית. שחזר מ britannica.com.
- ג 'ורג' סאמנר, ד 'ג' (s.f.). מה הם חלק מהשימושים עבור תחמוצת הנתרן? התאושש מ quora.com.
- המרכז הלאומי למידע ביוטכנולוגי. (S.F.). מסד הנתונים PubChem Compound; CID = 73971. מקור: pubchem.ncbi.nlm.nih.gov.
- החברה המלכותית לכימיה. (2015). תחמוצת נתרן. מאוחזר מ chemspider.com.
- Ruitao Wang, ק 'ק (2006). התגובה של מימן עם תחמוצת הנתרן: הידרוגנציה הפיכה / מערכת dehydrogenation. Journal of Power מקורות, Volume 155, Issue 2, 167-171. sciencedirect.com.
- תחמוצת נתרן (Na2O) (CAS 1313-59-3) MSDS. (2010-2017). מקור: guidechem: guidechem.com.
- נתרן: תחמוצת דיסודיום. (1993-2016). נלקח מ webelements: webelements.com.


