תורת הים של אלקטרונים יסודות, נכסים וחסרונות
ה תורת האלקטרונים של אלקטרונים זוהי השערה שמסבירה תופעה כימית חריגה המתרחשת בקשרי מתכת בין אלמנטים בעלי אלקטרו-אלקטרליות נמוכות. זה על שיתוף של אלקטרונים בין אטומים שונים המקושרים על ידי קשרים מתכת.
הצפיפות האלקטרונית בין הקישורים האלה היא כזו כי האלקטרונים הם delocalized וליצור "ים" שבו הם נעים בחופשיות. זה יכול גם לבוא לידי ביטוי על ידי מכניקת הקוונטים: כמה אלקטרונים (בדרך כלל אחד עד שבעה לכל אטום) מסודרים אורביטלים עם מרכזי מרובים כי הם מתוחים על פני השטח מתכת.
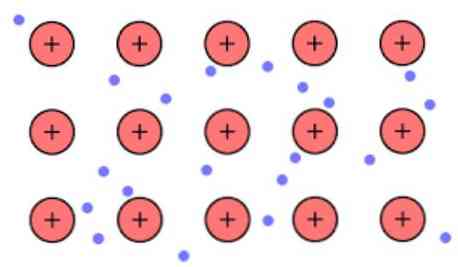
כמו כן, האלקטרונים שומרים על מיקום מסוים במתכת, אם כי ההסתברות ההסתברות של הענן האלקטרוני יש צפיפות גבוהה יותר סביב אטומים ספציפיים. זאת בשל העובדה כי בעת החלת זרם מסוים הם מראים את המוליכות שלהם בכיוון מסוים.
אינדקס
- 1 יסודות התיאוריה של ים האלקטרונים
- 2 מאפיינים
- 2.1 קיזוז בצורה של שכבות
- 2.2 תורת ים האלקטרונים בגבישים מתכתיים
- 3 חסרונות של התיאוריה
- 4 הפניות
יסודות התיאוריה של ים האלקטרונים
אלמנטים מתכתיים יש נטייה גדולה לתרום אלקטרונים מרמת האנרגיה האחרונה שלהם (שכבת הערכיות), בשל האנרגיה יינון שלהם נמוך כל כך ביחס אלמנטים אחרים.
בידיעה זו, כל רכיב מתכתי יכול להיחשב קטיון המקושר האלקטרון של רמת האנרגיה האחרונה שלה, אשר יהיה נוטה יותר לתרום.
כמתכת שיש מספר רב של אטומים כי מקושרים זה לזה, ניתן להניח כי המתכת יוצרת קבוצה של קטיונים מתכת שקועות מעין הים של אלקטרונים ערכיים אשר יש delocalization גדול.
בעוד הכוחות אלקטרוסטטיים של משיכה בין קטיון (מטען חיובי) ו האלקטרונים (מטען שלילי) יש אטומי מתכת מלוכדים בתוקף מדמיין delocalization של האלקטרונים הערכיים מתנהגים כמו דבק אלקטרוסטטית שומרת מקושר לקטיוני המתכת.
בדרך זו, ניתן להסיק כי מספר גדול יותר של אלקטרונים נוכח שכבת הערכיות של מתכת, זה סוג של דבק אלקטרוסטטי יהיה יותר כוח.
מאפיינים
התיאוריה של הים של אלקטרונים מציעה הסבר פשוט למאפיינים של מינים מתכתיים כגון התנגדות, מוליכות, משיכות וחדדנות, המשתנים ממתכת אחת לאחרת.
התברר כי ההתנגדות המוקנית למתכות נובעת מהדלוקליזציה הגדולה של האלקטרונים שלהם, היוצרת כוח לכידות גבוה מאוד בין האטומים המרכיבים אותו.
בדרך זו, משיכות ידועה היכולת של חומרים מסוימים כדי לאפשר את העיוות של המבנה שלהם, ללא תשואה מספיק כדי לשבור, כאשר נתון לכוחות מסוימים.
Offshoring בצורה של שכבות
משייכות ו גמישות שניהם מתכת הם נקבעים על ידי העובדה כי האלקטרונים הערכיים הם delocalized לכל הכיוונים בשכבות, אשר גורמת להם לעבור מעל אחד את השני נגד הפעולה של כוח חיצוני, הימנעות שבירת מבנה המתכת, אך מאפשר עיוות שלה.
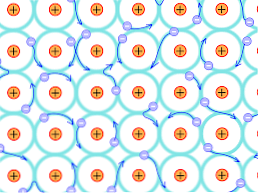
כמו כן, חופש התנועה של האלקטרונים delocalized מאפשר להיות זרם של זרם חשמלי, מה שהופך את המתכות יש מוליכות טובה מאוד של חשמל.
בנוסף, תופעה זו של תנועה חופשית של אלקטרונים מאפשרת העברת אנרגיה קינטית בין האזורים השונים של המתכת, אשר מקדמת את העברת החום וגורמת למתכות להפגין מוליכות תרמית גבוהה.
תיאוריית ים האלקטרונים בגבישים מתכתיים
הקריסטלים הם מוצקים בעלי תכונות פיזיקליות וכימיות כגון צפיפות, נקודת התכה בחומרה כי נקבעים על ידי סוג של כוחות שגורמים החלקיקים להישאר ביחד יוצרים.
במובן מסוים, זה נחשב כי גבישים של סוג מתכתי יש את המבנים הפשוטים ביותר, כי כל "נקודה" של רשת הגביש נכבשה על ידי אטום של המתכת עצמה.
במובן זה, נקבע כי בדרך כלל המבנה של גבישי המתכת הוא מעוקב ומתמקד בפנים או בגוף.
עם זאת, מינים אלה יכולים להיות גם משושה בצורת ויש להם אריזה קומפקטית למדי, אשר נותן להם צפיפות עצומה אופיינית.
בשל סיבה מבנית זו, הקשרים שנוצרו בגבישים המתכתיים שונים מאלה המתרחשים בסוגי גבישים אחרים. האלקטרונים שיכולים ליצור קשרים הם delocalised בכל המבנה הגבישי, כפי שהוסבר לעיל.
החסרונות של התיאוריה
באטומים מתכתיים יש כמות קטנה של אלקטרונים ערכיים ביחס לרמות האנרגטיות שלהם; כלומר, יש כמות גדולה יותר של אנרגיה זמין מדינות מאשר כמות האלקטרונים המקושרים.
משמעות הדבר היא כי, כפי שיש אנרגיה delocalization אלקטרונים חזק להקות כי יש מלא חלקית, האלקטרונים יכולים לנוע דרך מבנה הסריג כאשר נתון מהשדה החשמלי מבחוץ, מלבד להרכיב האלקטרון האוקיינוס התומך בחדירות של הרשת.
אז האיחוד של מתכות מתפרש כמו קונגלומרט של יונים טעונה חיובי יחד עם ים של אלקטרונים (טעונה שלילית).
עם זאת, ישנם מאפיינים שאינם מוסברים על ידי מודל זה, כגון היווצרות של סגסוגות מסוימות בין מתכות עם קומפוזיציות ספציפיות או יציבות של קישורים מתכת קולקטיבית, בין היתר..
חסרונות אלה מוסברים על ידי מכניקת קוונטים, כי בשני גישות רבות אחרות תאוריה זו הוקמו על בסיס הדגם הפשוט של אלקטרון בודד, בעת שניסתה להחיל במבנים מורכבים יותר של אטומי multielectron.
הפניות
- ויקיפדיה. (2018). ויקיפדיה. מקור: en.wikipedia.org
- הולמן, י 'ס' וסטון, פ. (2001). כימיה מאוחזר מ- books.google.co.il
- Parkin, G. (2010). מתכת מתכת מליטה. מאוחזר מ- books.google.co.il
- Rohrer, G. S. (2001). מבנה מליטה בחומרים גבישיים. מאוחזר מ- books.google.co.il
- Ibach, H., ו Lüth, H. (2009). פיזיקה של מצב מוצק: מבוא לעקרונות מדע החומרים. מאוחזר מ- books.google.co.il


