מאפייני דגם אטומי
ה מודל אטומי של ברולי הוצע על ידי הפיזיקאי הצרפתי לואי ברוגלי בשנת 1924. בתזה הדוקטורט שלו, טען ברולי את הדואליות של חלקיקי הגל של האלקטרונים, והניח את היסודות של מכניקת הגלים. ברולי פרסם ממצאים תיאורטיים חשובים על אופי הגל-קורפוסל של החומר בקנה מידה אטומי.
לאחר מכן, הצהרות Broglie הוכחו בצורה ניסויית על ידי מדענים קלינטון Davisson ו Lester Germer, בשנת 1927. התיאוריה של גלי ברוקלי אלקטרונים מבוסס על ההצעה של איינשטיין על תכונות גל של אור באורכי גל קצרים.
Broglie הודיעה על האפשרות כי החומר היה התנהגות דומה לזו של אור, והציע תכונות דומות בחלקיקים תת אטומיים כגון אלקטרונים.
חיובים חשמליים ומסלולים מגבילים את המשרעת, את האורך ואת התדירות של הגל המתואר על ידי אלקטרונים. ברולי הסביר את תנועת האלקטרונים סביב הגרעין האטומי.
אינדקס
- 1 מאפייני המודל האטומי של Broglie
- 2 ניסוי דוויסון וגרמר
- 3 מגבלות
- 4 מאמרים בעלי עניין
- 5 הפניות
מאפייני המודל האטומי של ברולי
כדי לפתח את הצעתו, החל ברולי מן העיקרון שלאלקטרונים יש אופי כפול בין גל לחלקיק, בדומה לאור.
במובן זה, עשה ברולי השוואה בין שתי התופעות, ובהסתמך על המשוואות שפיתח איינשטיין לחקר אופי הגל של האור, הוא ציין את הדברים הבאים:
- האנרגיה הכוללת של הפוטון, וכתוצאה מכך, האנרגיה הכוללת של האלקטרון, נובעת מתוצר של תדירות הגל וקבוע הפלנק (6.62606957 (29) × 10 -34 ג'ולס x שניות), כמפורט בביטוי הבא:
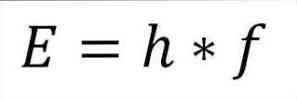
בביטוי זה:
E = אנרגיה אלקטרונים.
h = קבוע פלנק.
f = תדירות הגל.
- הרגע הליניארי של הפוטון, ולכן, של האלקטרון, הוא הפוך ביחס גל, ואת שני הגדלים קשורים דרך קבוע פלנק:
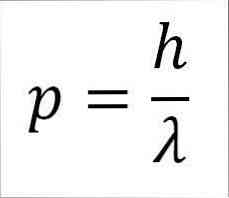
בביטוי זה:
p = רגע ליניארי של האלקטרון.
h = קבוע פלנק.
λ = אורך גל.
- התנופה הליניארית היא תוצר של המסה של החלקיקים על ידי המהירות שיש לחלקיק במהלך ההעתקה.
אם הביטוי המתמטי הקודם מאורגן מחדש כפונקציה של אורך גל, יש לנו את הדברים הבאים:
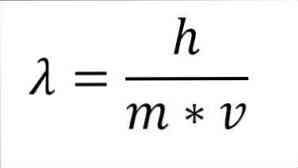
בביטוי האמור:
λ = אורך גל.
h = קבוע פלנק.
m = מסה של האלקטרון.
v = מהירות אלקטרונים.
מאז ח, קבוע פלנק, יש ערך קטן, λ אורך גל הוא גם. כתוצאה מכך, ניתן לקבוע כי תכונות הגל של האלקטרון מתרחשות רק ברמות אטומיות ותת-אטומיות.
- Broglie מבוססת גם על הנחות היסוד של המודל האטומי של בוהר. לדברי האחרון, המסלולים של האלקטרונים מוגבלים יכול להיות רק כפולות של מספרים שלמים. לכן:
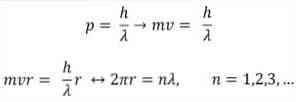
היכן
λ = אורך גל.
h = קבוע פלנק.
m = מסה של האלקטרון.
v = מהירות אלקטרונים.
r = רדיוס של מסלול.
n = מספר שלם.
על פי המודל האטומי של Bohr, אשר ברוגי אימצה כבסיס, אם האלקטרונים מתנהגים כמו גלים עומדים, המסלולים המותרים היחידים הם אלה שרדיוס שלהם שווה למספר בלתי נפרד של אורך הגל λ.
לכן, לא כל המסלולים עומדים בפרמטרים הדרושים לאלקטרון לעבור דרכם. לכן האלקטרונים יכולים לנסוע רק במסלולים ספציפיים.
תורת הגלים של האלקטרונים של ברולי הצדיקה את הצלחת המודל האטומי של Bohr כדי להסביר את התנהגותו של האלקטרון היחיד של אטום המימן.
באופן אנלוגי, זה גם לשפוך אור על למה המודל הזה לא התאים מערכות מורכבות יותר, כלומר, אטומים עם יותר מאלקטרון אחד.
ניסוי דייויסון וגרמר
האימות הניסויי של המודל האטומי של Broglie התקיים 3 שנים לאחר פרסומו, בשנת 1927.
הפיזיקאים האמריקנים הבולטים קלינטון ג'יי דייויסון ולסטר גרמר אישרו בניסוי את התיאוריה של מכניקת הגלים.
דיוויסון וגרמר ביצעו בדיקות פיזור של קרן אלקטרונים דרך גביש ניקל וצפו בתופעת העקיפה דרך המדיום המתכתי.
הניסוי בוצע בביצוע ההליך הבא:
- במקרה הראשון, הרכבה עם קרן אלקטרונים הוצב כי היה אנרגיה ראשונית ידוע.
- מקור מתח הותקן כדי להאיץ את תנועת האלקטרונים, מה שמביא לשינוי אפשרי.
- הזרימה של קרן האלקטרונים הופנתה אל גביש מתכתי; במקרה זה, ניקל.
- מספר האלקטרונים שהשפיעו על קריסטל הניקל נמדד.
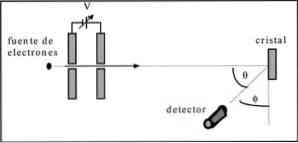
בסוף הניסוי גילו דייויסון וגרמר כי האלקטרונים מפוזרים לכיוונים שונים.
על ידי חזרה על הניסוי באמצעות גבישי מתכת עם אוריינטציות שונות, המדענים זיהו את הדברים הבאים:
- הפיזור של קרן האלקטרונים דרך הגביש המתכתי היה דומה לתופעה של הפרעות ועקיפה של קרני האור.
- ההשתקפות של האלקטרונים על גביש ההשפעה תיארה את המסלול, תיאורטית, צריך לתאר על פי התיאוריה של גלי אלקטרונים של Broglie.
בסינתזה, הניסוי של דייויסון וגרמר הוכיח בניסוי את טבעו של גל-חלקיקים כפול של אלקטרונים.
מגבלות
המודל האטומי של Broglie אינו מנבא את המיקום המדויק של האלקטרון במסלול שבו הוא נע.
במודל זה, האלקטרונים נתפשים כגלים המסתובבים במסלול ללא מיקום ספציפי, אשר מציג את הרעיון של מסלול אלקטרוני.
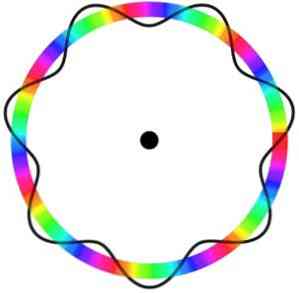
בנוסף, המודל האטומי של Broglie, הדומה למודל של שרדינגר, אינו מחשיב את סיבוב האלקטרונים על צירו (ספין).
על ידי התעלמות מהמומנטום הזוויתי הפנימי של האלקטרונים, מוזנחים השינויים המרחביים של חלקיקים תת-אטומיים אלה..
באותו סדר של רעיונות, מודל זה אינו לוקח בחשבון שינויים בהתנהגות של אלקטרונים מהירים כתוצאה של השפעות relativistic.
מאמרים בעלי עניין
דגם אטומי של שרדינגר.
דגם אטומי של צ'אדוויק.
דגם אטומי של הייזנברג.
מודל אטומי של פרין.
מודל אטומי של תומסון.
מודל אטומי של דלתון.
דגם אטומי של דיראק ירדן.
מודל אטומי של דמוקריטוס.
דגם אטומי של בוהר.
הפניות
- תורת הקוואנטים של בוהר וגלי דה ברולי (s.f.). מקור: ne.phys.kyushu-u.ac.j
- לואי דה ברולי - ביוגרפיה (1929). © קרן נובל. מקור: nobelprize.org
- לואי וויקטור דה ברולי (s.f.). מקור: chemed.chem.purdue.edu
- Lovett, B. (1998). לואי דה ברולי. אנציקלופדיה בריטניקה, Inc. מקור: britannica.com
- מודל אטומי של דה ברולי. האוניברסיטה הלאומית לחינוך מרחוק. ספרד מקור: ocw.innova.uned.es
- גלים של לואי דה ברולי (s.f.). מקור: hiru.eus
- פון פאמל, א ', ומארצ'סיו, ס' (ש '). מכניקה קוונטית האוניברסיטה הלאומית של רוסריו. מקור: fceia.unr.edu.ar


