דגם אטומי של דלטון פוסטולאטס
ה המודל האטומי של דלטון או התיאוריה האטומית של דלטון, זו היתה הצעה שהוצגה בין 1803 ו 1807 על ידי הכימאי האנגלי ואת המתמטיקאי ג 'ון דלתון. זו היתה ההצעה הראשונה של הארגון המושגי לגבי המבנה והתפקוד של האטומים.
מודל דלתון ידוע גם כדוגמה כדורית, שכן הוא מציע את העובדה כי האטום הוא בלתי ניתן לחלוקה, מוצק וקומפקטי. הודות למודל זה היה הרבה יותר קל לתת הסבר על כימיה לשאר העולם וזה היה הבסיס לפרויקטים מחקריים רבים אשר בעקבותיהם. יכול להסביר מדוע חומרים מגיבים במדינות מסוימות.
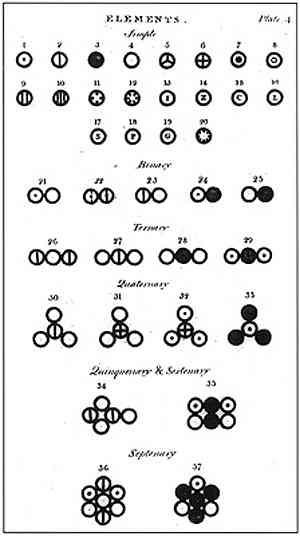
לדברי דלטון, החומר היה מורכב מיחידה מינימלית הנקראת אטום, שלא ניתן להיהרס או לחלוקה בשום אופן. יחידה זו, שהוצעה בעבר על ידי דמוקריטוס והמורה שלו Leucipo, היה הבסיס של המחקר של דלתון ויצירת המודל האטומי שלו.
בעזרת תיאוריה אטומית זו ניסה ג'ון דלטון לדון ברעיונות של הפילוסופים היוונים על קיומו של האטום (תיאוריה אטומית של היקום), אך באמצעות פלטפורמה ניסויים מעבדה שונים שאיפשרו לו להפגין את רעיונותיו.
אינדקס
- 1 פוסטולים של המודל האטומי של דלטון
- 1.1 postulated 1
- 1.2 פוסטולציה 2
- 1.3 פוסטולציה 3
- 1.4 פוסטולציה 4
- 1.5 postulate 5
- 1.6 לפרסם 6
- 2 שגיאות של המודל האטומי של דלתון
- 2.1 נוסחת מים
- 2.2 הרכבה של אטומים
- 3 מסקנות
- 4 התרומות העיקריות של דלטון
- 4.1 מבשר על תיאוריות אטומיות
- 4.2 הוא הניח את היסודות של הכימיה המודרנית
- 4.3 תחילה לפרסם טבלה של משקולות כימיות
- 4.4 תן שם לעיוורון צבעים
- מאמרים בעלי עניין
- 6 הפניות
פוסטולטים של המודל האטומי של דלתון
דלטון ניסח את המודל האטומי שלו עם 6 פוסטים שבהם הוא מסביר כיצד הוא ביסס את לימודיו ואיך הוא ביצע אותם.
לאחר 1

בתמונה שלעיל מוצג סיכום המודל של דלטון: האטומים יהיו כדורים זעירים שאינם ניתנים לחלוקה, בלתי ניתנים להפרדה והומוגניות.
הנחת היסוד הראשונה של דלתון קבעה כי האלמנטים מורכבים מחלקיקים זעירים הנקראים אטומים, שאינם ניתנים לחלוקה ולא ניתן להשמידם.
כמו כן, דלטון ציין כי חלקיקים אלה לא יכול לשנות בכל תגובה כימית.
לאחר 2

ההנחה השנייה של דלתון קבעה כי כל האטומים הקיימים באותו אלמנט שווים במשקל כמו במאפיינים אחרים.
מאידך גיסא, היא גם קבעה שלאטומים של אלמנטים שונים יש מסה שונה. מתוך הצעה זו התעוררה הידיעה על המשקלים האטומיים היחסיים שהוכחו בעת השוואת אלמנטים שונים במימן.
לאחר 3

הפוסטולציה השלישית של דלטון קבעה כי אטומים הם בלתי ניתנים לחלוקה גם כאשר הם משולבים בתגובות כימיות. הם גם לא יכולים להיווצר או להרוס.
השילוב של אטומים, שווים ושונים, ייצור תרכובות מורכבות יותר, אך תהליך זה לא ישנה את העובדה שהאטום הוא יחידת המינימום של החומר.
הנחה 4
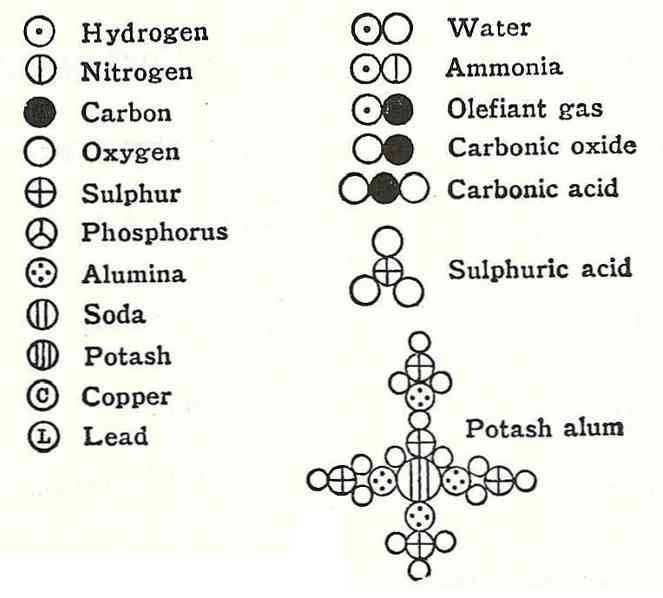
הפוסטולציה הרביעית של דלתון קבעה שגם כאשר האטומים משולבים כדי ליצור תרכובת, הם תמיד יהיו בעלי קשר שניתן לבטא במספרים פשוטים ומלאים. ביטוי זה לא יוצג בשברים, שכן האטומים אינם ניתנים לחלוקה.
תצהיר 5
ההנחה החמישית של דלתון קבעה כי קיים שילוב אפשרי של אטומים שונים בפרופורציות שונות כדי ליצור יותר מתרכובת אחת.
בדרך זו, ניתן להסביר כי מתוך כמות אטומית של אטומים כל החומר הקיים ביקום הגיע.
לאחר 6
הפלטפורמה השישית והאחרונה של דלתון קבעה שכל תרכובת כימית נוצרה משילוב האטומים של שני אלמנטים שונים או יותר.
טעויות של המודל האטומי של דלתון
כמו כל התיאוריה בעולם המדע, היו הרבה refutations ביחס המודל המוצע על ידי דלתון, אשר הוכיחו במשך השנים משאירים מאחור את הרעיונות החדשניים של דלתון.
נוסחת מים
דוגמה לכך היתה הטענה שניתנה על ידי דלטון על הנוסחה של מים, אשר אמר היה מורכב מימן וחמצן.
בשל הצהרה זו היו שגיאות רבות בחישוב ביחס למסה ולמשקל של כמה תרכובות בסיסיות שהתבססו על מידע זה.
כמה שנים לאחר מכן, מדענים אירופיים גיי-לוסאק ואלכסנדר פון הומבוסט הפריך את המידע הזה והוכיחו כי מים מורכבים למעשה משני מימן וחמצן אחד. 6 שנים מאוחר יותר Amadeo Avogadro הצביע על ההרכב המדויק של המים ובגלל זה יש את חוק אבוגדרו.
הרכב האטומים
מאידך גיסא, במאה העשרים התגלה ההרכב האמיתי של האטומים. במקרה זה הוכח כי יש יחידה קטנה יותר כגון פרוטונים, אלקטרונים ונייטרונים.
כמו כן, קיומו של משקלים אטומיים שונים שנקבעו בטבלה המחזורית של מנדלייב ומאייר, קיומם של איזוטופים ומאפיינים כימיים ספציפיים יותר, עלה.
מסקנות
למרות השגיאות שלו, התרומות של ג 'ון דלתון היו רלוונטיות רבה בעולם המדע וגרמה לעורר בזמנו בשל כמות גדולה של מידע שהוא סיפק.
התרומות המדעיות שלך עדיין תקפות ועדיין נחקרות.
המודל האטומי של דלתון לא נחקר במשך עשרות שנים, בשל הרלוונטיות שלו בעולם המדע והסבר הנכון שלו לחקירות ולהשערות שהוצגו באותו רגע בהיסטוריה של המדע.
התרומות העיקריות של דלתון
תרומתו לעולם המדע היתה בעיקר להבהיר ולנסח השערות על הטבע באמצעות בדיקות כמותיות.
המדען נפטר מהתקף לב ב -27 ביולי 1884 במנצ'סטר וזמן קצר אחרי שזכה בהצטיינות מהמלוכה.
מבשר את התיאוריות האטומיות
ג'ון דלטון היה כימאי אנגלי, מתמטיקאי וכימאי. הוא נולד ב -6 בספטמבר 1766 בקמברלנד שבממלכה המאוחדת, והוא ידוע כאחד מבשריו של תיאוריות אטומיות מרגע שהציג את דגם האטום שלו..
הוא הניח את יסודות הכימיה המודרנית
דלתון ידוע כאחד מבכירי יצירת טבלת משקולות יחסית עבור יסודות כימיים. עובדה זו סייעה להניח את היסודות של מה שאנו מכירים כיום כימיה מודרנית.
תחילה לפרסם טבלה של משקולות כימיות
דלטון היה המדען הראשון שהיה לו הכבוד לפרסם טבלה של משקולות אטומיות שכללו אלמנטים כגון מימן, חמצן, זרחן, פחמן וגופרית. הודות לפרסום זה החל דלטון לעבוד ולעצב מה יהיה המודל האטומי שלו.
תן שם לעיוורון צבעים
יצוין כי דלתון היה אחד האנשים הראשונים רשומים עם בעיות ראייה ללכוד את הצבעים ובגלל זה מצב זה נקרא בשם עיוורון צבעים.
מאמרים בעלי עניין
דגם אטומי של שרדינגר.
דגם אטומי של ברולי.
דגם אטומי של צ'אדוויק.
דגם אטומי של הייזנברג.
מודל אטומי של פרין.
מודל אטומי של תומסון.
דגם אטומי של דיראק ירדן.
מודל אטומי של דמוקריטוס.
דגם אטומי של בוהר.
הפניות
- התיאוריה האטומית של דלטון. ב -24 בנובמבר 2017, מתוך Chanacademy: www.khanacademy.org
- התיאוריה האטומית של דלטון. לאחזר ב 24 בנובמבר 2017, מן אינדיאנה אוניברסיטת צפון מערב: iun.edu
- תיאוריה אטומית. ב -24 בנובמבר 2017, מתוך אנציקלופדיה בריטניקה: www.britannica.com
- תיאוריה אטומית. ב -24 בנובמבר 2017, מתוך ויקיפדיה: en.wikipedia.org
- היסטוריה של מבנה אטומי. אחזור ב -24 בנובמבר 2017, מאת לומן: courses.lumenlearning.com.


