מגנזיום הידריד נוסחה, מבנה כימי ומאפיינים
ה מגנזיום הידריד (MGH2 של הנוסחה המולקולרית), הוא תרכובת כימית עם תוכן במשקל של מימן של 7.66%, ומצא בטבע כמו מוצק גבישי לבן. הוא משמש בעיקר להכנת חומרים כימיים אחרים, אם כי הוא נחקר גם כאמצעי אחסון פוטנציאלי עבור מימן.
הוא שייך למשפחה של הידרדים מלוחים (או יוניים), אלה שהוגדרו על ידי H- יון טעונה שלילית. Hydrides אלה נחשבים אלה נוצרים מתכות אלקליות ומתכות אלקליין הארץ, אבל במקרה של מגנזיום (ו בריליום) יש קשרים קוולנטיים, בנוסף אלה יונים המאפיינים את המשפחה הזאת של hydrides.
אינדקס
- הכנה ונוסחה
- מבנה כימי
- 3 תכונות פיסיקליות וכימיות
- 3.1 פיזית
- 3.2 כימיקלים
- 4 שימושים
- 4.1 אחסון מימן
- 4.2 תגובות של הידרוגנציה ו dehydrogenation
- 4.3 בוץ
- 4.4 תאי דלק
- 4.5 תחבורה ואנרגיה
- 4.6 אלקילציה
- 5 סיכונים
- 5.1 תגובה עם מים
- 5.2 זה pyrophoric
- 6 הפניות
הכנה ונוסחה
מגנזיום הידריד נוצר באמצעות הידרוגנציה ישירה של מגנזיום (Mg) מתכת בתנאים של לחץ גבוה וטמפרטורה (200 אטמוספרות, 500 מעלות צלזיוס) עם זרז MgI2. תגובתו שווה ל:
Mg + H2→ MgH2
הייצור של MgH נחקר גם2 בטמפרטורות נמוכות יותר עם השימוש של מגנזיום nanocrystalline המיוצר טחנות הכדור.
ישנן גם שיטות אחרות של הכנה, אך הן מייצגות תגובות כימיות מורכבות יותר (הידרוגנציה של מגנזיום-אנתרקן, התגובה בין דיאתילמגנזיום עם הידרידי של ליתיום-אלומיניום, וכמוצר של קומפלקס MgH2).
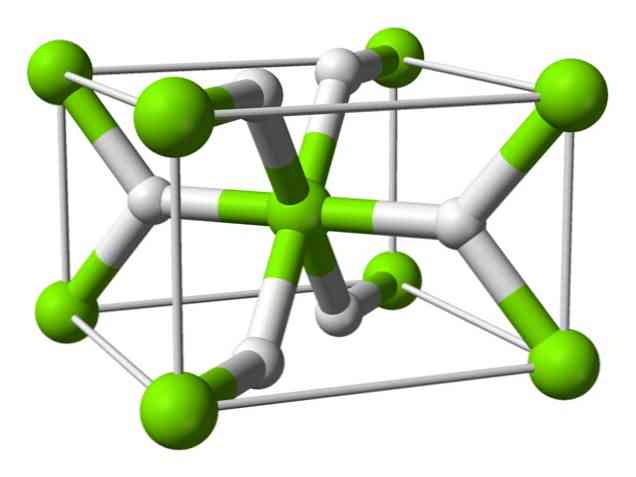
מבנה כימי
אטום זה יש מבנה של רוטיל בטמפרטורת החדר, עם מבנה גבישי tetragonal. יש לו לפחות ארבע צורות שונות תחת תנאי לחץ גבוה, וכן מבנה שאינו stoichiometric עם חסרונות מימן יש גם נצפתה; האחרון מתרחש רק בכמויות קטנות מאוד של חלקיקים כאשר נוצר.
כפי שצוין לעיל, את הקשרים הקיימים במבנה רוטיל יש מאפיינים קוולנטיים חלקית במקום להיות יונית בלבד, כמו הידרידים מלוחים אחרים.
זה גורם אטום מגנזיום יש צורה כדורית, מיונן לחלוטין, אבל יון הידריד שלה יש מבנה מוארך.
תכונות פיסיקליות וכימיות
גופנית
- מראה: גבישים לבנים.
- מסה טוחנת: 26.3209 גרם / mol
- צפיפות: 1.45 גרם / ס"מ3
- נקודת התכה: 285 מעלות צלזיוס מתפרקת
- מסיסות: במים מתפרק.
תרכובת כימית זו יש משקל מולקולרי של 26,321 גרם / מול, צפיפות של 1.45 גרם / cm3 ויש לו נקודת ההתכה של 327 מעלות צלזיוס.
כימיקלים
- מבשר לייצור חומרים כימיים אחרים.
- אחסון מימן, כמקור אפשרי של אנרגיה.
- צמצום סוכן בסינתזה אורגנית.
חשוב לציין כי תרכובת זו לא ניתן להביא למצב נוזלי, וכאשר הוא נישא או נקודת ההיתוך שלה או הציג לתוך המים, הוא מתפרק. Hydride זה אינו מסיס באתר.
זהו חומר תגובתי מאוד דליק מאוד, והוא גם pyrophoric, כלומר, זה יכול להצית באופן ספונטני באוויר. שלושת התנאים הללו מייצגים סיכונים ביטחוניים שיזכירו בחלק האחרון של מאמר זה.
שימושים
אחסון מימן
מגנזיום הידריד מגיב בקלות עם מים כדי ליצור גז מימן, דרך התגובה הכימית הבאה:
MGH2+2H2O → 2H2+Mg (OH)2
בנוסף, חומר זה מתפרק בטמפרטורה של 287 מעלות צלזיוס ולחץ של 1 בר, כדלקמן:
MGH2→ Mg + H2
לכן, השימוש hydride מגנזיום כמו מדיום אחסון מימן עבור השימוש שלה התחבורה הוצע.
הידרוגנציה ודה-הידרוגנציה של כמות מגנזיום מתכתי מוצעת כדרך להעברת כמויות של מימן גזי, ובכך להבטיח שאין דליפה בהובלה, המייצגת שיטה בטוחה ומעשית יותר מאשר בשימוש בכלי לחץ גבוהים..
הידרוגנציה ו dehydrogenation תגובות
למרות טמפרטורת הפירוק של מגנזיום הידריד מייצג גורם מגביל עבור השימוש בו, שיטות הוצעו כדי לשפר את הקינטיקה של הידרוגנציה ו dehydrogenation התגובות. אחד מהם הוא עם הפחתת גודל של חלקיק מגנזיום עם השימוש של טחנות הכדור.
בוץ
בנוסף, הוצעה מערכת המייצרת מגנזיום הידריד בצורה של בוץ (יותר לניהול ובטוח יותר מאשר אבקה או חלקיקים מוצקים אחרים), אשר יגיב עם מים כדי להשיג את המימן הרצוי.
ההערכה היא כי בוצה בשם בעבר ייווצר על ידי הידריד הקרקע דק, מוגן עם שכבת מגן של שמנים ו מושעה בפיזור סוכנים על מנת להבטיח כי היא שומרת על עקביות ללא אובדן של החומר, וכי הוא אינו סופג לחות מהסביבה..
בוצה זה יש את היתרון כי זה יכול להיות שאוב דרך כל דיזל, דלק או משאבת מים, מה שהופך הצעה כלכלית זו, כמו גם יעיל.
תאי דלק
מגנזיום הידריד יכול להיות מיושם בייצור של תאים דלק מתקדמים, וגם ביצירת סוללות ואחסון אנרגיה.
תחבורה ואנרגיה
במהלך העשורים האחרונים, נחשב השימוש במימן כמקור אנרגיה. ההשתלה של מימן כדלק, דורשת מציאת מערכות אחסון בטוחות ו הפיכות ועם קיבולת נפחית גבוהה (כמות מימן ליחידת נפח) וגרווימטרי (כמות מימן ליחידת מסה).
אלקילציה
Alkylation (הוסף CH קבוצות אלקיל3R) של תרכובות אורגניות במדיום בסיסי, שבו יש נוכחות של קבוצות -OH בריכוזים נמוכים וטמפרטורות גבוהות יותר מאשר נקודת ההתכה של הידריד.
במקרה זה ההידרוגנים הנוכחים מגנזיום הידריד (MgH2), להצטרף לקבוצות -OH להרכיב מים. מגנזיום חופשי יכול לקבל את הלוגן המלווה לעיתים קרובות את מולקולת אלקיל המיועדת לקשור את שרשרת הפחמימנים.
סיכונים
תגובה עם מים
כפי שכבר צוין, הידריד מגנזיום הוא חומר המגיב בקלות ובאלימות עם מים, המציג את היכולת להתפוצץ בריכוז גבוה יותר.
זה קורה כי התגובה אקסותרמית שלה מייצר מספיק חום כדי להצית את גז המימן שפורסמו בתגובה הפירוק, מה שמוביל לתגובת שרשרת מסוכן למדי..
זה פירופי
מגנזיום הידריד הוא גם pyrophoric, כלומר, זה יכול להצית באופן ספונטני בנוכחות אוויר לח, וצורות תחמוצת מגנזיום ומים.
שאיפתו אינה מומלצת במצב מוצק או במגע עם האדים שלה: החומר במצבו הטבעי ומוצריו בפירוק עלולים לגרום לפציעות חמורות או אפילו למוות.
זה יכול ליצור פתרונות קורוזיביים במגע עם מים זיהום של זה. מגע עם העור והעיניים לא מומלץ, וגם מייצר גירוי של ריריות הממברנות.
זה לא הוכח כי מגנזיום הידריד יכול לייצר השפעות בריאותיות כרוניות, כגון סרטן, פגמים הרבייה או השלכות פיזיות או נפשיות אחרות, אבל השימוש בציוד מגן מומלץ בעת הטיפול בו (במיוחד מנשמים או מסכות, על שלה אופי אבק דק).
כאשר עובדים עם חומר זה, לחות של האוויר חייב להישמר ברמות נמוכות, לכבות את כל מקורות ההצתה ולהעביר אותו בתופים או מיכלי מכולה אחרים..
אתה תמיד צריך להימנע מעבודה עם ריכוזים גדולים של חומר זה כאשר ניתן להימנע, כמו האפשרות של פיצוץ פוחתת באופן משמעותי.
אם נשפך מגנזיום הידריד, אזור העבודה צריך להיות מבודד את האבק שנאסף עם שואב אבק. אתה אף פעם לא צריך להשתמש בשיטה גורפת יבש; מגדילה את הסיכויים לתגובה עם הידריד.
הפניות
- Zumdahl, S. S. (1998). אנציקלופדיה בריטניקה. נלקח מ britannica.com.
- PubChem. (2005). הפתיחה פתח כימיה מסד נתונים. נלקח מתוך pubchem.ncbi.nlm.nih.gov.
- מימן בטוח, L. (2006). קרון רכב ירוק. נלקח מ greencarcongress.com.
- כימיקלים, C. (n.d). כימיקלים בכימיקלים. נלקח מתוך.
- שירותים, N. J. (1987). ניו ג 'רזי מחלקת הבריאות ושירותי בכיר. נלקח מ nj.gov.


