סוגים גיאומטריים מולקולריים ודוגמאות
ה גיאומטריה מולקולרית o מבנה מולקולרי היא ההתפלגות המרחבית של אטומים סביב אטום מרכזי. האטומים מייצגים אזורים שבהם יש צפיפות אלקטרונית גבוהה, ולכן נחשבים לקבוצות אלקטרוניות, ללא תלות בקישורים הנוצרים (יחיד, כפול או משולש).
מושג זה מגיע משילוב ואת נתוני הניסוי של שתי תאוריות: הקשר הערכי (TEV) והדחייה של זוגות האלקטרונים של הפגז הערכי (VSEPR). בעוד הראשון מגדיר את הקישורים ואת הזוויות שלהם, השני קובע את הגיאומטריה, ולכן, המבנה המולקולרי.

אילו צורות גיאומטריות הן מולקולות המסוגלות לאמץ? שתי התיאוריות הקודמות מספקות את התשובות. על פי VSEPR, אטומים וזוגות של אלקטרונים חופשיים חייב להיות מסודרים בחלל באופן כזה כדי למזער את הדחייה האלקטרוסטטית ביניהם..
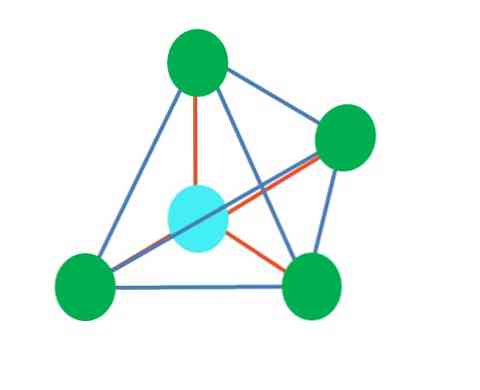
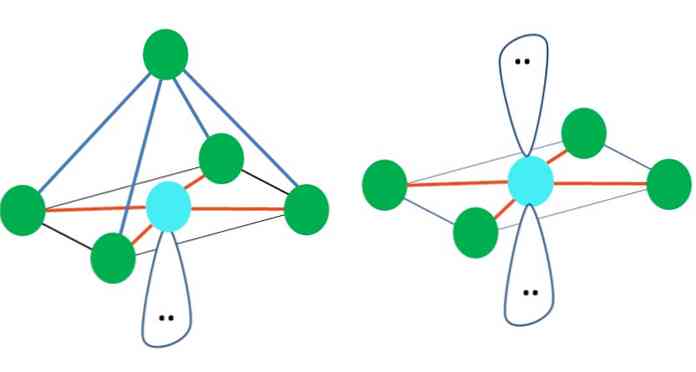
אז, צורות גיאומטריות אינם שרירותיים, אבל לחפש את העיצוב היציב ביותר. לדוגמה, בתמונה העליונה משולש ניתן לראות בצד שמאל, אוקטאהדרון ימינה. הנקודות הירוקות מייצגות את האטומים ואת הפסים הכתומים הקישורים.
במשולש, שלוש הנקודות הירוקות מכוונות בהפרדה של 120 מעלות. זווית זו, השווה לזו של הקשר, מאפשרת לאטומים להדוף זה את זה ככל האפשר. לכן, מולקולה עם אטום מרכזי המצורפת לשלושה אחרים תאמץ גיאומטריה המטוס טריגונל.
עם זאת, VSCR חוזה כי זוג חינם של אלקטרונים באטום המרכזי יעוות את הגיאומטריה. במקרה של המטוס הטריגונלי, זוג זה ידחוף את שלוש הנקודות הירוקות, וכתוצאה מכך יצרו גיאומטריה של פירמידה טריגונלית.
אותו הדבר יכול לקרות גם עם האוקטהדרון של התמונה. בו כל האטומים מופרדים בדרך יציבה ביותר האפשרית.
אינדקס
- 1 כיצד לדעת מראש את הגיאומטריה המולקולרית של אטום X?
- 2 סוגים
- 2.1 ליניארי
- 2.2 זוויתי
- 2.3 Tetrahedral
- 2.4 טריפונאל ביפראמיד
- 2.5 Octahedral
- 2.6 גיאומטריות מולקולריות אחרות
- 3 דוגמאות
- 3.1 גיאומטריה לינארית
- 3.2 גיאומטריה זוויתית
- 3.3 תוכנית טריגונית
- 3.4 טטרדראל
- 3.5 פירמידה טריגונלית
- 3.6 טריגונל ביפירמיד
- 3.7 תנודות
- 3.8 צורה של T
- 3.9 אוקתדרלה
- 4 הפניות
כיצד לדעת מראש את הגיאומטריה המולקולרית של אטום X?
לשם כך, יש צורך גם לשקול את זוגות של אלקטרונים חופשיים כמו קבוצות אלקטרוניות. אלה, יחד עם האטומים, יגדיר את מה שמכונה גיאומטריה אלקטרונית, שהוא לוויה בלתי נפרד של גיאומטריה מולקולרית.
מן הגיאומטריה האלקטרונית, ולאחר שזוהו על ידי מבנה לואיס זוגות של אלקטרונים חופשיים, אנו יכולים לקבוע מה הגיאומטריה המולקולרית יהיה. סכום כל הגיאומטריות המולקולריות יספק קווי מתאר של המבנה הגלובלי.
סוגים
כפי שניתן לראות בתמונה הראשית, הגיאומטריה המולקולרית תלויה בכמה אטומים מקיפים את האטום המרכזי. עם זאת, אם זוג אלקטרונים קיים ללא שיתוף, זה יהיה לשנות את הגיאומטריה כי היא תופסת הרבה נפח. לכן, זה מפעיל אפקט סטריי.
על פי זה, גיאומטריה יכולה להציג סדרה של צורות אופייניות עבור מולקולות רבות. וזה המקום שבו סוגים שונים של גיאומטריה מולקולרית או מבנה מולקולרי להתעורר.
כאשר הגיאומטריה שווה למבנה? שניהם מציינים אותו הדבר רק במקרים שבהם המבנה אינו כולל יותר מסוג אחד של גיאומטריה; אחרת, יש לשקול את כל סוגי ההווה ואת המבנה שניתן לשם גלובלי (ליניארי, מסועף, כדורי, שטוח וכו ')..
הגיאומטריות שימושיות במיוחד כדי להסביר את המבנה של מוצק מן היחידות המבניות שלה.
ליניארי
כל הקשרים קוולנטיים הם כיווניים, ולכן הקישור A-B הוא ליניארי. אבל האם מולקולת AB תהיה ליניארית?2? אם כן, הגיאומטריה מיוצגת פשוט כמו: B-A-B. שני האטומים B מופרדים בזווית של 180 °, ועל פי TEV, חייב להיות spbit היברידית היברידית.
זוויתית
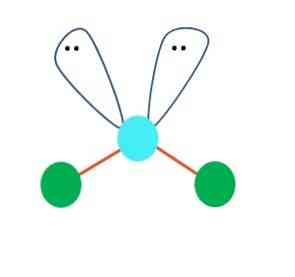
ניתן להניח, במקרה הראשון, בגיאומטריה לינארית למולקולת א.ב.2; עם זאת, חיוני כדי לצייר את המבנה של לואיס לפני שהגיע למסקנה. ציור המבנה של לואיס, אפשר לזהות את מספר זוגות של אלקטרונים ללא שיתוף (:) על האטום של A.
כאשר זה כך, על גבי זוגות האלקטרון הם דוחפים את שני האטומים של B למטה, שינוי הזוויות שלהם. כתוצאה מכך, המולקולה ליניארית B-A-B בסופו של דבר הופך V, בומרנג או גיאומטריה זוויתית (תמונה עליונה)
מולקולת המים, H-O-H, היא הדוגמה האידיאלית לסוג זה של גיאומטריה. באטום החמצן יש שני זוגות של אלקטרונים ללא שיתוף אשר מכוונים בזווית משוערת של 109 מעלות.
מדוע זווית זו? בגלל הגיאומטריה האלקטרונית היא tetrahedral, אשר יש ארבעה קודקודים: שניים עבור אטומי H, ושניים עבור אלקטרונים. בתמונה שלמעלה יש לציין כי הנקודות הירוקות ושתי "אונות עם העיניים" לצייר טטרהדרון עם נקודה כחלחלה במרכז שלה.
אם O אין זוגות אלקטרונים חופשיים, המים ליצירת מולקולה ליניארית, ולהפחית אוקיינוסים קוטביים, ימים, אגמים, וכו ', היה כנראה לא מקיימים כפי ידוע.
Tetrahedral
התמונה העליונה מייצגת את הגיאומטריה tetrahedral. עבור מולקולת המים, הגיאומטריה האלקטרונית שלה היא tetrahedral, אבל על ידי ביטול זוגות ללא אלקטרון ניתן להבחין כי הוא הפך לגיאומטריה זוויתי. זה גם ציין פשוט על ידי ביטול שתי נקודות ירוקות; את שני הנותרים יהיה לצייר את V עם נקודה כחולה.
מה אם במקום שני זוגות של אלקטרונים חופשיים היה רק אחד? ואז יהיה מטוס טריגונלי (התמונה הראשית). עם זאת, על ידי ביטול קבוצה אלקטרונית, אפקט סטריי המיוצר על ידי זוג אלקטרונים חופשיים הוא לא נמנע. לכן, זה מעוות את המטוס טריגונל לפירמידה בסיס משולש:

למרות טריגונלית ו tetrahedral פירמידה גיאומטריה מולקולרית שונים, הגיאומטריה האלקטרונית זהה: tetrahedral. אז הפירמידה הטריגונית אינה נחשבת לגיאומטריה אלקטרונית?
התשובה היא לא, שכן הוא התוצאה של העיוות שנגרמה על ידי "עיני האונה" והתוצאה הסטרית שלה, וכי גיאומטריה אינה מביאה לידי ביטוי עיוות הבאים בחשבון.
מסיבה זו, זה תמיד חשוב קודם לקבוע גיאומטריה אלקטרונית בעזרת מבנים לואיס לפני הגדרת הגיאומטריה המולקולרית. מולקולת האמוניה, NH3, הוא דוגמה של טריגונלית פירמידית הגיאומטריה המולקולרית, אבל עם הגיאומטריה האלקטרונית tetrahedral.
טריגונאל ביפראמיד
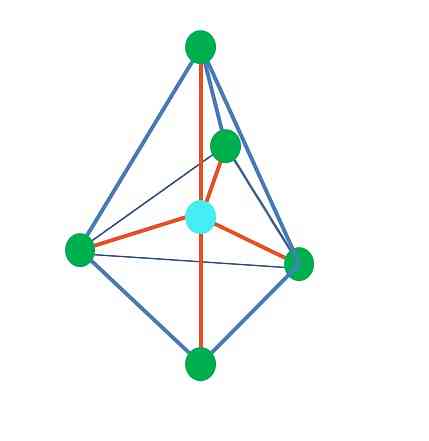
עד כה, למעט הגיאומטריה ליניארית, ב tetrahedral, זוויתי ואת פירמידה טריגונלית אטומים מרכזיים יש הכלאה sp3, על פי TEV. משמעות הדבר היא כי אם זוויות הקישור שלך נקבעו באופן ניסיוני, הם צריכים להיות סביב 109 מעלות.
מ geometry טריגונל dipiramidal, יש חמש קבוצות אלקטרוניות סביב האטום המרכזי. בתמונה העליונה ניתן לראות עם חמש נקודות ירוקות; שלושה בבסיס המשולש, ושניים במיקומים ציריים, שהם הקודקודים העליונים והתחתונים של הפירמידה.
מה הכלאה עושה נקודה כחולה יש אז? זה צריך חמישה אורביטלים היברידיים כדי ליצור את האג"ח פשוט (כתום). זה מושג באמצעות 5 spbit אורביטלים3d (תוצר של תערובת של s מסלולית, שלושה p ו d).
כאשר שוקלים לחמש קבוצות אלקטרוניות, הגיאומטריה נחשפה כבר, אבל שיש זוגות אלקטרוני unshared, זה שוב סובל עיוותים כי גיאומטריות אחרות. כמו כן, מתעוררת השאלה הבאה: האם זוגות אלה יכולים לתפוס כל תפקיד בפירמידה? אלה הם: ציר או קו המשווה.
עמדות ציר ושווי משקל
הנקודות הירוקות שמרכיבות את הבסיס המשולש נמצאות בתנוחות קו המשווה, ואילו השניים בקצה העליון והתחתון, בתנוחות ציריות. איפה, עדיף, יהיה זוג אלקטרונים ללא שיתוף ממוקם? במצב זה ממזער דחייה אלקטרוסטטית אפקט סטריי.
Axially באיתור זוג האלקטרונים היו "לחץ" בניצב (90) על הבסיס המשולש, בעוד אם במצב משווני, הקבוצות האלקטרוניות שני הנותרים של הבסיס תהיינה 120 מעלות זה מזה והיה לוחץ שני הקצוות 90 ° (במקום שלושה, כמו עם הבסיס).
לכן, האטום המרכזי יבקש לכוון את זוגות האלקטרון החופשיים שלו בעמדות המשווניות כדי ליצור גיאומטריות מולקולריות יציבות יותר.
מתנדט צורה T
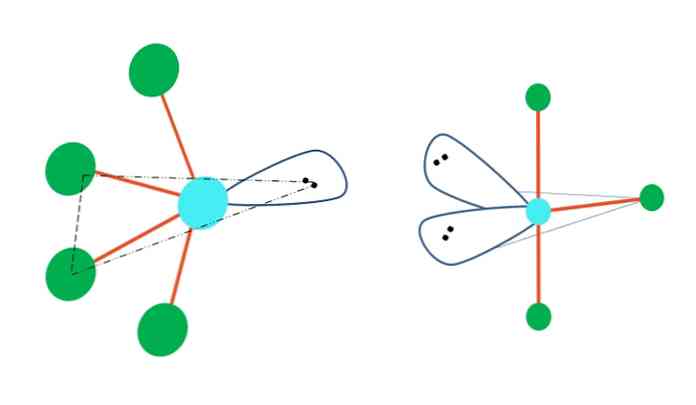
אם הגיאומטריה הביפירמידה הטריגונלית הייתה אמורה להחליף אחד או יותר מהאטומים שלה עם זוגות ללא אלקטרון, יהיה לה גם גיאומטריה מולקולרית שונה.
משמאל לתמונה העליונה, הגיאומטריה משתנה לצורה המתנדנדת. בתוכו, זוג האלקטרונים החופשי דוחף את שאר ארבעת האטומים באותו כיוון, ומקפל את הקישורים שלהם שמאלה. שים לב כי זוג זה שניים של אטומים שוכבים באותו מטוס משולש של דיפירמיד המקורי.
וגם הימני של התמונה, את הגיאומטריה בצורת T זה גיאומטריה מולקולרית היא התוצאה של החלפת שני אטומים ידי שני זוגות אלקטרונים, ועקב וכתוצאה מכך שלושת האטומים הנותרים מיושרים על אותו המישור, להרכיב בדיוק אות אחת T.
אז, עבור מולקולה מסוג AB5, היא מאמצת גיאומטריה טריפונלית bipyramid. עם זאת, AB4, עם אותה גיאומטריה אלקטרונית, היא תאמץ את הגיאומטריה נדנוד; ו AB3, את הגיאומטריה בצורת T. בכולם יש רצון (בדרך כלל) הכלאה sp3ד.
כדי לקבוע את הגיאומטריה המולקולרית יש צורך לצייר את המבנה לואיס ולכן הגיאומטריה האלקטרונית שלה. אם זהו ביפירמידה טריגונלית, אז זוגות ללא אלקטרון יהיה מושלך, אבל לא את ההשפעות הסטריות שלהם על שאר האטומים. לכן, ניתן להבחין באופן מושלם בין שלוש הגיאומטריות המולקולריות האפשריות.
אוקטאדרלה
הגיאומטריה המולקולרית octahedral מיוצג בצד ימין של התמונה הראשית. סוג זה של גיאומטריה מתאים תרכובות AB6. א.ב.4 הם יוצרים את הבסיס הריבועי, בעוד שני הנותרים B ממוקמים בתנוחות צירית. כך, כמה משולשים שווה צלעות נוצרים, שהם פניהם של האוקטהדרון.
כאן, שוב, יכול להיות (כמו בכל הגיאומטריות האלקטרוניות) זוגות אלקטרון חופשיים, ולכן, גיאומטריות מולקולריות אחרות נובעות מהעובדה הזאת. לדוגמה, AB5 עם גיאומטריה אלקטרונית octahedral מורכב פירמידה עם בסיס מרובע, ו- AB4 מטוס מרובע:
במקרה של גיאומטריה אלקטרונית octahedral, אלה שתי הגיאומטריות המולקולריות הם היציבים ביותר במונחים של דחייה אלקטרוסטטית. בגיאומטריה מרובעת מישורית, שני זוגות האלקטרון הם 180 מעלות זה מזה.
מהי הכלאה עבור אטום A בגיאומטריות אלה (או מבנים, אם הוא היחיד)? שוב, TEV קובע כי הוא sp3ד2, שישה אורביטלים היברידיים, המאפשר A לכוון קבוצות אלקטרוניות על קודקודים של אוקטדרון.
גיאומטריות מולקולריות אחרות
על ידי שינוי הבסיסים של הפירמידות שהוזכרו עד כה, כמה גיאומטריות מולקולריות מורכבות יותר ניתן להשיג. לדוגמה, bipyramid pentagonal מבוססת על מחומש ואת התרכובות שיוצרים אותו יש נוסחה כללית AB7.
כמו הגיאומטריות המולקולריות האחרות, החלפת אטומי B עבור זוגות ללא אלקטרון יעוות את הגיאומטריה לצורות אחרות.
כמו כן, תרכובות AB8 הם יכולים לאמץ גיאומטריות כגון אנטי-ריבוע מרובע. כמה גיאומטריות יכול להיות מסובך מאוד, במיוחד עבור נוסחאות AB7 (עד א"ב)12).
דוגמאות
לאחר מכן, סדרה של תרכובות יהיה מוזכר עבור כל הגיאומטריה המולקולרית העיקרית. בתור תרגיל, אתה יכול לצייר את מבנים לואיס עבור כל הדוגמאות ולאשר אם, בהתחשב בגיאומטריה האלקטרונית, אתה מקבל את הגיאומטריות המולקולריות המפורטות להלן..
גיאומטריה ליניארית
-אתילן, ח2C≡CH2
-בריליום כלוריד, BeCl2 (Cl-Be-Cl)
-פחמן דו חמצני, CO2 (O = C = O)
-חנקן, נ2 (N≡N)
-מרקורי dibromide, HgBr2 (Br-Hg-Br)
-אניון triiodide, אני3- (I-I-I)
-ציאניד מימן, HCN (H-N≡C)
זוויות שלה חייב להיות 180 מעלות, ולכן יש הכלאה sp.
גיאומטריה זוויתית
-המים
-דו תחמוצת הגופרית, SO2
-דו תחמוצת החנקן, NO2
-אוזון, O3
-אניון אמידורו, NH2-
מטוס טריגונל
-ברום trifluoride, BF3
-אלומיניום trichloride, AlCl3
-ניטראט אניון, לא3-
-אניון קרבונט, CO32-
Tetrahedral
-גז מתאן, CH4
-פחמן tetrachloride, CCl4
-קטיון אמוניום, NH4+
-אניון גופרתי, SO42-
פירמידה טריגונלית
-אמוניה, NH3
-Ced hydronium, H3הו+
טריגונאל ביפראמיד
-זרחן pentafluoride, PF5
-אנטיכומין פנתכלוריד, SbF5
מתנודדת
גופרית tetrafluoride, SF4
צורה של T
-יוד טריכלוריד, ICL3
-כלוריד trifluoride, CLF3 (שני המרכיבים ידועים interhalogens)
אוקטאדרלה
-גופרית הקספלואוריד, SF6
-סלניום hexafluoride, Sef6
-Hexafluorophosphate, PF6-
כדי שיגיע, הגיאומטריה המולקולרית היא מה שמסביר את התצפיות של התכונות הכימיות או הפיסיקליות של החומר. עם זאת, היא מכוונת על פי הגיאומטריה האלקטרונית, כך האחרון חייב תמיד להיות נקבע לפני הראשון.
הפניות
- ויטן, דייוויס, פק & סטנלי. כימיה (8th ed.). CENGAGE למידה, עמ '194-198.
- צמרמורת & אטקינס. (2008). כימיה אנאורגנית (מהדורה רביעית, עמ '23, 24, 80, 169). מק גרב היל.
- מארק א. טוקרמן. (2011). גיאומטריה מולקולרית ותיאוריית VSEPR. מקור: nyu.edu
- וירטואלי Chembook, צ 'ארלס E. Ophardt. (2003). מבוא לגיאומטריה מולקולרית. מקור: chemistry.elmhurst.edu
- כימיה. (8 בספטמבר 2016). גיאומטריה של מולקולות. מקור: chem.libretexts.org


