איזון של משוואות כימיות שיטות ודוגמאות
ה איזון משוואות כימיות מרמז כי לכל האלמנטים הקיימים במשוואה האמורה יש מספר זהה של אטומים בכל צד. כדי להשיג זאת יש צורך להשתמש בשיטות איזון להקצות את מקדמים stoichiometric מתאים לכל מינים נוכח התגובה.
משוואה כימית היא הייצוג, באמצעות סמלים, של מה שקורה במהלך תגובה כימית בין שני חומרים או יותר. המגיבים אינטראקציה זה עם זה, בהתאם לתנאי התגובה, אחד או יותר תרכובות שונות יתקבלו כמוצר..
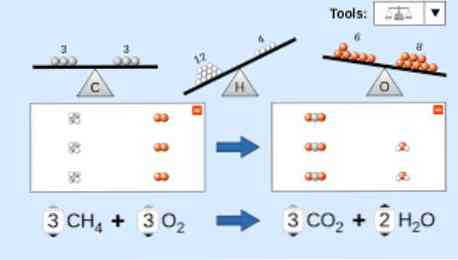
כאשר משוואה כימית תארה צריכה להילקח בחשבון: חומרים מגיבים ראשונים כתובים בצד השמאל של המשוואה, ואחריו חץ חד כיווני או שני חיצים אופקים היפך, תלוי בסוג של תגובה להתבצע קייפ.
אינדקס
- שיטות לאיזון משוואות כימיות
- 1.1 מאזן משוואות כימיות לפי ניסוי וטעייה (הנקרא גם בדיקה או ניסוי)
- 1.2 איזון אלגברי של משוואות כימיות
- 1.3 רולינג של משוואות לחזור (שיטת יון אלקטרונים)
- דוגמאות לאיזון משוואות כימיות
- 2.1 דוגמה ראשונה
- 2.2 דוגמה שנייה
- 2.3 דוגמה שלישית
- 3 הפניות
שיטות איזון של משוואות כימיות
בהתבסס על המגיבים ומוצרים ידועים, והנוסחות שלהם באות לידי ביטוי בצורה נכונה את הצד המתאים להם, זה ממשיך לאזן משוואות פי השיטות הבאות.
איזון משוואות כימיות על ידי ניסוי וטעייה (המכונה גם בדיקה או ניסוי)
היא מבוססת על והרכב של התגובה והוא מנסה עם מקדמים שונים כדי לאזן את המשוואה, ובלבד מספרי השלמים הקטנים ביותר האפשריים עם אותו המספר האטומי של כל רכיב מתקבלים על שני צדדים נבחרים תגובה.
מקדם מגיב או מוצר הוא המספר שלפני הנוסחא, והוא המספר היחיד שיכול להיות שונה כאשר משוואת האיזון מתבצעת, שכן אם התחתי של הנוסחא מוחלף יהיה שינוי זהות של המתחם הנדון.
לספור ולהשוות
לאחר שזיהה כל אלמנט של התגובה והניח אותו בצד הנכון, אנו ממשיכים לספור ולהשוות את מספר האטומים של כל אלמנט הנוכחי במשוואה ולקבוע את אלה שיש לאזן.
לאחר מכן, אנו ממשיכים עם האיזון של כל רכיב (אחד בכל פעם), על ידי הצבת מקדמים שלמים לפני כל נוסחה המכילה אלמנטים לא מאוזנים. בדרך כלל האלמנטים המתכתיים מאוזנים תחילה, ואז האלמנטים הלא מתכתיים ולבסוף אטומי החמצן והמימן.
בדרך זו, כל מקדם מכפיל את כל האטומים של הנוסחה הקודמת; אז תוך איזון אלמנט שהאחרים יכולים לאזן, אבל זה מתוקן כמו התגובה מאוזנת.
לבסוף, זה מאושש על ידי ספירה אחרונה כי המשוואה כולה מאוזנת כראוי, כלומר, כי הוא מציית לחוק שימור החומר.
איזון אלגברי של משוואות כימיות
כדי להשתמש בשיטה זו, נוצר הליך לטיפול במקדמים של משוואות כימיות כבלתי ידועים של המערכת שיש לפתור..
ראשית נלקח כנקודת התייחסות אלמנט מסוים של התגובה ואת המקדמים כאותיות (a, b, c, d ...) המייצג את הנעלמים, על פי אטומים קיימים של אלמנט שבכל מולקולה ממוקמת (אם זן אינו מכיל אלמנט כי מושם "0").
לאחר קבלת המשוואה הראשונה, נקבעים המשוואות של שאר היסודות המופיעים בתגובות; יהיו משוואות רבות כפי שיש אלמנטים התגובה אמר.
לבסוף, הבלתי ידועים נקבעים על ידי אחת השיטות האלגבריות של הפחתה, שוויון או החלפה ומקדמים מתקבלים כי התוצאה משוואה מאוזנת כראוי.
איזון משוואות החזרה (שיטת אלקטרונים יון)
ראשית התגובה הכללית (לא מאוזנת) ממוקמת בצורת יונית שלה. אז משוואה זו מחולקת לשתי תגובות למחצה, חמצון וצמצום, כל איזון לפי מספר האטומים, סוג שלהם ואת ההאשמות של אלה.
לדוגמה, עבור התגובות המתרחשות במדיום חומצי, מולקולות H מתווספות.2או כדי לאזן את אטומי החמצן ולהוסיף H+ כדי לאזן את אטומי המימן.
לעומת זאת, במדיום אלקליין מספר שווה של יונים OH נוסף- על שני הצדדים של המשוואה עבור כל יון+, ואיפה יונים יונים+ ו OH- הם באים יחד כדי ליצור מולקולות H2הו.
הוסף אלקטרונים
אז אתה חייב להוסיף כמו אלקטרונים רבים ככל הנדרש כדי לאזן את החיובים, לאחר איזון העניין בכל חצי תגובה.
לאחר התגלגלות של כל תגובה למחצה, אלה מוסיפים ומסתיימים על ידי איזון המשוואה הסופית על ידי ניסוי וטעייה. במקרה שיש הבדל במספר האלקטרונים של שתי התגובות למחצה, יש להכפיל אחד או את שניהם במקדם השווה למספר זה.
לבסוף, יש לאשש כי המשוואה כוללת את אותו מספר של אטומים ואת אותו סוג של אטומים, בנוסף שיש את אותם חיובים משני צידי המשוואה הגלובלית.
דוגמאות לאיזון משוואות כימיות
דוגמה ראשונה
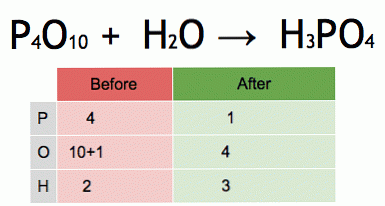
זוהי אנימציה של משוואה כימית מאוזנת. זרחן זרחן ומים מומרים חומצה זרחתית.
P4O10 + 6 H2O → 4 H3PO4 (-177 kJ).
דוגמה שנייה
יש לך את התגובה בעירה של אתאן (לא מאוזן).
ג2ח6 + הו2 → CO2 + ח2הו
באמצעות השיטה של ניסוי וטעייה כדי לאזן אותו, הוא ציין כי אף אחד המרכיבים יש את אותו מספר של אטומים על שני צידי המשוואה. לכן, זה מתחיל עם מאזן הפחמן, הוספת שניים כמו מקדם stoichiometric המלווה אותו בצד המוצרים.
ג2ח6 + הו2 → 2CO2 + ח2הו
הפחמן כבר מאוזן משני הצדדים, ולכן אנו ממשיכים לאזן את המימן על ידי הוספת שלושה למולקולת המים.
ג2ח6 + הו2 → 2CO2 + 3H2הו
לבסוף, כמו בצד ימין של המשוואה יש שבעה אטומי חמצן הוא חסר האחרון על ידי איזון מספר השבר 7/2 לפני מולקולת חמצן מושם (למרות מקדמים שלמים מעדיפים בדרך כלל).
ג2ח6 + 7 / 2O2 → 2CO2 + 3H2הו
לאחר מכן ודא כי בכל צד של המשוואה יש את אותו מספר של אטומי פחמן (2), מימן (6) וחמצן (7).
דוגמה שלישית
החמצון של ברזל על ידי יונים dichromate מתרחשת בינוני חומצה (לא מאוזן בצורת יונית שלה).
אמונה2+ + Cr2הו72- → אמונה3+ + Cr3+
באמצעות שיטת אלקטרונים יון עבור האיזון שלה, זה מחולק לשני תגובות חצי.
חמצון: אמונה2+ → אמונה3+
הפחתה: Cr2הו72- → Cr3+
מאז אטומי הברזל כבר מאוזן (1: 1), אלקטרון נוסף בצד המוצרים כדי לאזן את החיוב.
אמונה2+ → אמונה3+ + ה-
עכשיו האטומים של Cr מאוזנים, הוספת שני בצד ימין של המשוואה. ואז, כאשר התגובה מתרחשת במדיום חומצה, שבעה מולקולות H מתווספים.2או בצד של המוצרים כדי לאזן את אטומי החמצן.
Cr2הו72- → 2Cr3+ + 7H2הו
כדי לאזן את האטומים H, ארבעה עשר יונים נוספים+ על הצד של המגיבים, לאחר השוואת החומר, המטענים מאוזנים על ידי תוספת של שישה אלקטרונים באותו צד.
Cr2הו72- +14H+ + 6e- → 2Cr3+ + 7H2הו
לבסוף, שתי התגובות למחצה מתווספות, אך מכיוון שיש רק אלקטרון אחד בתגובת החמצון, כל זה מוכפל בשש.
6 דה2+ + Cr2הו72- +14H+ + 6e- → אמונה3+ + 2Cr3+ + 7H2O + 6e-
לבסוף, האלקטרונים חייבים להיות משוחררים משני צדי המשוואה היונית הגלובלית, המאמתים שהמטען והחומר שלהם מאוזנים כהלכה.
הפניות
- Chang, R. (2007). כימיה (9). מקגרו היל.
- Hein, M., and Arena, S. (2010). יסודות כימיה של המכללה, אלטרנטיבה. מאוחזר מ- books.google.co.il
- טולי, ג 'ד', וסוני, פ 'ל' (2016). שפת הכימיה או משוואות כימיות. מאוחזר מ- books.google.co.il
- פרסום מהיר (2015). משוואות כימיה ותגובות (מדריכי לימוד מהיר). מאוחזר מ- books.google.co.il


