רדיוס אטומי איך הוא נמדד, איך זה משתנה בטבלה המחזורית, דוגמאות
ה רדיוס אטומי זהו פרמטר חשוב עבור המאפיינים התקופתיים של מרכיבי הטבלה המחזורית. זה קשור ישירות לגודל של האטומים, שכן ברדיוס גדול, גדול או מגושם הם. כמו כן, הוא קשור למאפיינים אלקטרוניים של אותו.
כל עוד אטום יש אלקטרונים יותר, כך גדל גודל שלה רדיוס אטומי. שניהם מוגדרים על ידי האלקטרונים של פגז הערכיות, מכיוון שבמרחקים מעבר למסלולים שלהם, ההסתברות למציאת אלקטרון מתקרבת לאפס. ההפך מתרחש בסביבה של הגרעין: ההסתברות למציאת אלקטרון עולה.

התמונה העליונה מייצגת אריזה של כדורי כותנה. שים לב שכל אחד מהם מוקף בשישה שכנים, מבלי לספור עוד שורה עליונה או תחתונה נוספת. הדרך שבה הם דחוסים כדורי צמר גפן יהיה להגדיר את הגודל שלהם, ולכן, רדי שלהם; בדיוק כמו שזה קורה עם אטומים.
אלמנטים על פי הטבע הכימי שלהם אינטראקציה עם האטומים שלהם בדרך זו או אחרת. לכן, גודל הרדיוס האטומי משתנה בהתאם לסוג הקשר הקיים והאריזה המוצקה של האטומים.
אינדקס
- 1 כיצד מודדים את רדיוס האטום?
- 1.1 קביעת המרחק הגרעיני
- 1.2 יחידות
- 2 כיצד זה משתנה בטבלה המחזורית?
- 2.1 במשך תקופה
- 2.2 יורד על ידי קבוצה
- 2.3 התכווצות Lanthanide
- 3 דוגמאות
- 4 הפניות
כיצד מודדים את רדיוס האטום?
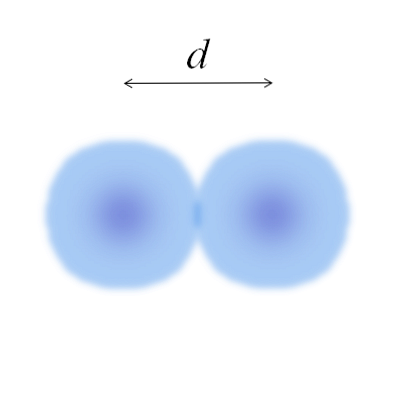
בתמונה הראשית זה יכול להיות קל למדוד את הקוטר של כדורי הכותנה, ולאחר מכן לחלק אותו בשניים. עם זאת, תחום האטום אינו מוגדר במלואו. למה? כי אלקטרונים להפיץ ולפזר באזורים ספציפיים של שטח: אורביטלים.
לכן, האטום יכול להיחשב ככדור עם קצוות בלתי מתפשרים, אשר אי אפשר לומר בוודאות עד כמה הם מסתיימים. לדוגמה, בתמונה העליונה, אזור המרכז, ליד הגרעין, נראה בצבע חזק יותר, בעוד הקצוות שלו מטושטשים.
התמונה מייצגת מולקולה דיאטומית E2 (כמו Cl2, ח2, הו2, וכו '). בהנחה כי האטומים הם גופים כדוריים, אם המרחק נקבע ד המפריד בין שני הגרעינים בקשר הקוולנטי, אז זה מספיק כדי לחלק אותו לשני חצאים (ד/ 2) כדי להשיג את רדיוס אטומי; ליתר דיוק, רדיוס קוולנטי של E עבור E2.
ואם E לא יוצר קשרים קוולנטיים עם עצמו, אבל זה אלמנט מתכתי? ואז ד זה יהיה מסומן על ידי מספר השכנים המקיפים E במבנה המתכתי שלה; כלומר, לפי מספר התיאום (N.C) של האטום בתוך האריזה (זוכרים את כדורי הכותנה של התמונה הראשית).
קביעת המרחק הגרעיני
כדי לקבוע ד, המהווה את המרחק הגרעיני עבור שני אטומים במולקולה או אריזה, זה דורש טכניקות ניתוח פיזי.
אחד מהשימוש הנפוץ ביותר הוא עקיפה של קרני X. בהקרנה של קרן מוקרנת דרך גביש, ודפוס העקיפה הנובע מהאינטראקציות בין אלקטרונים לקרינה אלקטרומגנטית נלמד. בהתאם האריזה, דפוסי השתברות שונים ניתן להשיג, ולכן, ערכים אחרים של ד.
אם האטומים הם "הדוקים" בסריג הגביש, הם יציגו ערכים שונים של ד לעומת מה שהיה להם אילו היו "נוחים". כמו כן, מרחקים גרעיניים אלה יכולים להתנדנד בערכים, כך רדיוס אטומי למעשה מורכב הערך הממוצע של מדידות כאלה.
איך קשור הרדיוס האטומי ומספר התיאום? V. Goldschmidt הקים קשר בין השניים, שבו עבור N.C של 12, הערך היחסי הוא 1; מ 0.97 עבור אריזה שבה האטום יש N.C שווה ל 8; של 0.96, עבור N.C שווה ל 6; ו 0.88 עבור N.C של 4.
יחידות
מהערכים של N.C שווים ל -12, נבנו טבלאות רבות המשוות את רדיוס האטום של כל מרכיבי הטבלה המחזורית.
מאחר שלא כל האלמנטים יוצרים מבנים קומפקטיים כאלה (N.C פחות מ -12), היחס של V. Goldschmidt משמש לחישוב רדיוס האטום שלהם ולבטא אותם לאריזה זהה. בדרך זו, מדידות של רדיום אטומי הם סטנדרטיים.
אבל באילו יחידות הם מבטאים את עצמם? מאז ד הוא בעל גודל קטן מאוד, צריך להיות ניצל את יחידות angstrom Å (10 ∙ 10-10מ ') או גם בשימוש נרחב, picometer (10 ∙ 10-12m).
איך זה משתנה בטבלה המחזורית?
בכל תקופה
רדיומי האטום שנקבעו עבור אלמנטים מתכתיים מקבלים את השם של רדיוס מתכתי, ואילו עבור אותם אלמנטים מתכתיים, רדיוסים קוולנטיים (כגון זרחן, P)4, או גופרית, S8). עם זאת, בין שני סוגי מכשירי רדיו יש הבדל בולט יותר מאשר שם.
משמאל לימין באותה תקופה, הגרעין מוסיף פרוטונים ואלקטרונים, אך אלה מוגבלים לאותה רמת אנרגיה (מספר הקוונטים הראשי). כתוצאה מכך, הגרעין מפעיל תשלום גרעיני יעיל יותר ויותר על האלקטרונים valence, אשר חוזים רדיוס אטומי.
בדרך זו, אלמנטים מתכתיים באותה תקופה נוטים להיות רדיאליים אטומיים (קוולנטיים) קטנים יותר ממתכות (רדיאלי מתכתי).
יורד על ידי קבוצה
כאשר יורד על ידי קבוצה, רמות חדשות של אנרגיה מופעלים, המאפשרים אלקטרונים יש יותר מקום. לפיכך, ענן אלקטרונית מכסה מרחקים גדולים יותר, פריפריה מטושטשת בסופו של דבר משם רחוק יותר מן הגרעין, ולכן, רדיוס אטומי מתרחב.
התכווצות Lanthanide
האלקטרונים של השכבה הפנימית מסייעים להגן על המטען הגרעיני האפקטיבי על האלקטרונים הערכיות. כאשר האורביטלים שמרכיבים את השכבות הפנימיות יש "חורים" רבים, כמו עם אורביטלים F, הגרעין חזק חוזק רדיוס אטומי עקב אפקט מסוכך המסכן של האורביטלים..
עובדה זו מעידה על התכווצות lanthanide בתקופה 6 של הטבלה המחזורית. מ La ל HF יש התכווצות ניכרת של רדיוס אטומי המיוצר על ידי אורביטלים F, אשר "למלא" כמו אחד עובר דרך בלוק F: זה של lanthanoids ו אקטואידים.
אפקט דומה ניתן לראות גם עם אלמנטים של לחסום p מתקופה 4. הפעם המוצר של אפקט סיכוך חלש של אורביטלים ד כי להתמלא בעת חציית תקופות של מתכות המעבר.
דוגמאות
עבור תקופה 2 של הטבלה המחזורית רדיום האטום של האלמנטים שלה הם:
-Li: 257
-Be: 112 pm
-ב: 88 בערב
-C: 77 בערב
-N: 74 בערב
-O: 66 pm
-F: 64: 00
שימו לב שלמתכת הליתיום יש רדיוס אטומי גדול (257), ואילו פלואורין, הממוקם בקצה הימני של התקופה, הוא הקטן שבהם (64:00). רדיוס האטום יורד משמאל לימין באותה תקופה, והערכים הרשומים מציגים אותו.
ליתיום, על ידי יצירת קשרים מתכתיים, רדיוס שלה הוא מתכתי; ופלואורין, כפי שהוא יוצר קוולנטיים (F-F), רדיוס שלה הוא קוולנטי.
ואם אתם רוצים לבטא את הרדיו האטומי ביחידות של אנגסטרום? פשוט לחלק אותם על ידי 100: (257/100) = 2.57Å. וכך הלאה עם שאר הערכים.
הפניות
- כימיה 301. רדיום אטומי. מקור: ch301.cm.utexas.edu
- קרן CK-12. (28 ביוני 2016). רדיוס אטומי. מקור: chem.libretexts.org
- מגמות אטומי רדיוס. נלקח מ: intro.chem.okstate.edu
- המכללה הקהילתית. (2002). גודל אטומי. מקור: dl.clackamas.edu
- קלארק ג '(אוגוסט 2012). רדיוס אטומי ויוני. מקור: chemguide.co.uk
- צמרמורת & אטקינס. (2008). כימיה אנאורגנית (מהדורה רביעית, עמ '23, 24, 80, 169). מק גרב היל.


