הפעלה כימית אנרגיה מה זה מורכב, חישוב
ה אנרגיית הפעלה כימית (מנקודת המבט של מחקרים קינטיים) מתייחס לכמות הפחות האפשרית של האנרגיה הדרושה כדי להתחיל תגובה כימית. על פי התיאוריה של התנגשויות קינטיקה כימית, הוא אמר כי כל המולקולות בתנועה יש כמות מסוימת של אנרגיה קינטית.
משמעות הדבר היא שככל שהמהירות שלך גבוהה יותר, כך גדלה עוצמת האנרגיה הקינטית שלך. במובן זה, מולקולה שנושאת תנועה מהירה לא יכולה להיות מחולקת לשברים בפני עצמה, ולכן התנגשות חייבת להתרחש בינה לבין מולקולה אחרת, כך שתגובה כימית יכולה להתרחש.
כאשר זה קורה - כאשר מתרחשת התנגשות בין המולקולות - חלק קטן מהאנרגיה הקינטית שלה הופך לאנרגיה רטט. כמו כן, אם בתחילת התהליך האנרגיה הקינטית גבוהה, המולקולות המשתתפות בהתנגשות יציגו רטט כה גדול, שכמה מהקשרים הכימיים הנוכחיים יהיו שבורים..
שבירת קישורים זו היא הצעד הראשון בהפיכת המגיבים למוצרים; כלומר, במבנה של אלה. מאידך גיסא, אם בתחילת התהליך הזה האנרגיה הקינטית היא בעלת גודל קטן, תהיה תופעה של "ריבאונד" של המולקולות, שדרכן הן יופעלו כמעט ללא פגע..
אינדקס
- 1 מה זה מורכב??
- 1.1 הופעל מורכב
- 2 איך זה מחושב?
- 2.1 חישוב אנרגיית ההפעלה של תגובה כימית
- 3 כיצד משפיע אנרגיית ההפעלה על מהירות התגובה?
- 4 דוגמאות לחישוב אנרגיית ההפעלה
- 5 הפניות
מה זה מורכב??
החל מתפיסה של התנגשויות בין מולקולות כדי ליזום את התגובות הכימיות שתוארו בעבר, ניתן לומר כי יש כמות מינימלית של אנרגיה הדרושה להתנגשות להתרחש.
לכן, אם ערך האנרגיה הוא פחות מהמינימום הדרוש, לא יהיה שום שינוי בין המולקולות לאחר ההתנגשות, מה שאומר שכאשר אנרגיה זו נעדרת, המינים המעורבים נשארים כמעט ללא שינוי ולא יתרחשו. כל שינוי עקב הלם זה.
בסדר זה של הרעיונות, האנרגיה המינימלית הדרושה לשינוי תתרחש לאחר התנגשות בין מולקולות נקרא אנרגיית הפעלה.
במילים אחרות, המולקולות המעורבות בהלם חייבות להיות בעלות של אנרגיה קינטית מוחלטת בעלת גודל שווה או גדול מאנרגיה של ההפעלה, כך שתגובה כימית יכולה להתרחש.
כמו כן, במקרים רבים המולקולות מתנגשות ומייצרות מין חדש הנקרא מבנה מורכב ומורכב, הנקרא גם "מצב מעבר" משום שהוא קיים רק באופן זמני.
זה נגרם על ידי מינים מגיב עקב התנגשות לפני היווצרות של מוצרים של התגובה.
הופעל מורכב
הקומפלקס הפעיל שהוזכר לעיל יוצר מינים בעלי יציבות נמוכה מאוד, אשר, בתורו, יש כמות גדולה של אנרגיה פוטנציאלית.
התרשים הבא מציג את השינוי של המגיבים למוצרים, המתבטא במונחים של אנרגיה וציין כי עוצמת האנרגיה של המכלול הפעיל שנוצר הוא גדול בהרבה מזה של המגיבים ומוצרים..
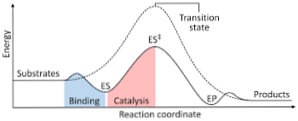
אם בסוף התגובה למוצרים יש יציבות גדולה יותר מאשר חומרים מגיבים, שחרור של אנרגיה מתרחשת בצורה של חום, מתן תגובה אקסותרמית..
להיפך, אם המגיבים גורמים ליציבות בסדר גודל גדול יותר מהמוצר, פירוש הדבר שתערובת התגובה מבטאת קליטת אנרגיה בצורה של חום מסביבתה, וכתוצאה מכך תגובה אנדותמית..
כמו כן, אם מקרה זה או אחר מתרחשת, יש לבנות תרשים, כמו זה שהוצג קודם לכן, שבו האנרגיה הפוטנציאלית של המערכת שמגיב נגד ההתקדמות או ההתקדמות של התגובה הוא זממו..
בדרך זו, השינויים האנרגיה הפוטנציאליים המתרחשים כמו התגובה ממשיך מתקבלים המגיבים הופכים למוצרים.
איך זה מחושב?
אנרגיית ההפעלה של תגובה כימית קשורה קשר הדוק למהירות המהירות של אותה תגובה, והתלות של קבוע זה בטמפרטורה מיוצגת על ידי משוואת ארניוס:
k = Ae-Ea / RT
בביטוי זה k מייצג את קצב קבוע של התגובה (אשר תלוי בטמפרטורה) ואת הפרמטר א זה נקרא גורם תדר, וזה מדד של התדירות של התנגשויות בין מולקולות.
מצידה, ה מבטאת את הבסיס לסדרת הלוגריתמים הטבעיים. הוא מועלה לכוח השווה למינון השלילי של אנרגיית ההפעלה (אה) בין המוצר הנובע מקבוע הגז (R) ואת הטמפרטורה המוחלטת (T) של המערכת לשקול.
יש לציין כי גורם התדר יכול להיחשב כמערכת קבועה במערכות תגובה מסוימות על פני טווח טמפרטורות רחב.
ביטוי מתמטי זה היה אמור במקור על ידי הכימאי ממוצא הולנדי יעקבוס הנריקוס ואנט הוף בשנת 1884, אך מי נתן לו תוקף מדעי ופרש את הנחת היסוד שלו היה כימאי שנולד שוודית סוונטה ארניוס, בשנת 1889.
חישוב אנרגיית ההפעלה של תגובה כימית
משוואת ארניוס מציינת את המידתיות הישירה הקיימת בין קבוע המהירות של התגובה לבין תדירות ההתנגשויות בין המולקולות.
כמו כן, משוואה זו יכולה להיות מיוצגת בצורה נוחה יותר על ידי יישום המאפיין של logarithms טבעי לכל צד של המשוואה, קבלת:
ln = ln A - EA / RT
כאשר reordering את התנאים כדי להשיג את המשוואה של קו (y = mx + b), הביטוי הבא מושגת:
ln k = (- Ea / R) (1 / T) + ln
לכן, כאשר בונים גרף של ln k לעומת 1 / T אנו משיגים קו ישר, כאשר ln k מייצג את הקואורדינטות y, (- A / R) מייצג את שיפוע הקו (m), (1 / T) מייצג את הקואורדינטות x, ו- ln מייצג את הצומת עם ציר הקווים (b).
כפי שניתן לראות, המדרון הנובע מחישוב זה שווה לערך של -Aa / R. משמעות הדבר היא, כי אם רצוי להשיג את הערך של אנרגיה ההפעלה באמצעות ביטוי זה, ניקוי פשוט צריך להתבצע, וכתוצאה מכך:
Ea = -mR
כאן אנו יודעים את הערך של m ו- R הוא שווה קבוע ל 8.314 J / K · mol.
כיצד משפיעה אנרגיית ההפעלה על מהירות התגובה?
כאשר מנסים ליצור תמונה של אנרגיה ההפעלה, זה יכול להיחשב כמחסום זה אינו מאפשר תגובה להתרחש בין מולקולות האנרגיה התחתונה.
כמו בתגובות שכיחות קורה שמספר המולקולות שיכולות להגיב הוא די גדול, המהירות - ושוויון, האנרגיה הקינטית של המולקולות האלה - יכולה להיות משתנה מאוד.
בדרך כלל קורה כי רק כמות קטנה של מכלול המולקולות שחוו התנגשות - אלה שיש להן מהירות תנועה גבוהה יותר - מציגות מספיק אנרגיה קינטית כדי להתגבר על עוצמת אנרגיית ההפעלה. אז, מולקולות אלה הם מסוגלים ויכולים להיות חלק מהתגובה.
על פי משוואת ארניוס, הסימן השלילי - שקודם לממוצע בין אנרגיית ההפעלה לבין תוצר קבוע הגז על ידי הטמפרטורה המוחלטת - מעיד על כך שהירידה המהירה יורדת ככל שיש עלייה באנרגיית ההפעלה, כמו גם גידול כאשר הטמפרטורה עולה.
דוגמאות לחישוב אנרגיית ההפעלה
כדי לחשב את האנרגיה ההפעלה על ידי בניית גרף, על פי משוואת Arrhenius, יש לנו כי קבועי קצב התגובה ריקבון של אצטאלדהיד נמדדו בחמש טמפרטורות שונות ואנחנו רוצים לקבוע את האנרגיה ההפעלה עבור התגובה, אשר באה לידי ביטוי:
CH3CHO (g) → CH4(g) + CO (g)
הנתונים של חמש המדידות הם:
k (1 / M1/2· S): 0.011 - 0.035 - 0.105 - 0.343 - 0.789
T (K): 700 - 730 - 760 - 790 - 810
ראשית, כדי לפתור את זה לא ידוע ולקבוע את האנרגיה ההפעלה, עלינו לבנות גרף של ln k לעומת 1 / T (y לעומת x), כדי לקבל קו ישר מכאן לקחת את המדרון ולמצוא את הערך של Ea, כפי שהוסבר.
הפיכת הנתונים של המדידות, לפי משוואת ארניוס [ln k = (- Ea / R) (1 / T) + ln A] נמצאו הערכים הבאים עבור y ו- x, בהתאמה:
ln: (-4.51) - (-3.35) - (-2.254) - (-1.070) - (-0.237)
1 / T (K-1): 1.43 * 10-3 - 1.37 * 10-3 - 1.32 * 10-3 - 1,27 * 10-3 - 1,23 * 10-3
מערכים אלה ובאמצעות חישוב מתמטי של המדרון - בין אם במחשב ובין אם במכונה, באמצעות הביטוי m = (Y2-Y1) / (X2-X1) או באמצעות שיטת רגרסיה ליניארית - אנו מקבלים את זה m = -Aa / R = -2.09 * 104 ק.
Ea = (8.314 J / K · mol) (2.09 * 10)4 K)
= 1.74 * 105 = 1.74 * 102 kJ / mol
כדי לקבוע אנרגיות אחרות של הפעלה דרך הגרפית, הליך דומה מבוצעת.
הפניות
- ויקיפדיה. (s.f.). הפעלת אנרגיה. מקור: en.wikipedia.org
- Chang, R. (2007). כימיה, מהדורה תשיעית. מקסיקו: מקגרו-היל.
- בריטניקה, א '(s.f.). אנרגיית הפעלה. מקור: britannica.com
- מור, ג 'יי וו' פירסון, ר 'ג' (1961). קינטיקה ומנגנון. מאוחזר מ- books.google.co.il
- קאשה, ח '(2003). קורוזיה של מתכות: עקרונות פיסיקוכימיים ובעיות עכשוויות. מאוחזר מ- books.google.co.il


