אלקטרוליטים חזקים וחלשים, הבדלים, דוגמאות
ה אלקטרוליטים הם חומרים המייצרים פתרון מוליך חשמלית כאשר מומס בתוך קוטב ממס, כגון מים. אלקטרוליט מומס מופרד קטיונים ואניונים, אשר התפזרו הפתרון אמר. אם הפוטנציאל החשמלי מוחל על הפתרון, קטיונים ידבק האלקטרודה כי יש שפע של אלקטרונים.
לעומת זאת, האניונים בפתרון יחוברו לאלקטרודה הלקויה בחשמל. חומר המנתק ליונים רוכש את היכולת לנהל חשמל. רוב המלחים, חומצות בסיסים מסיסים לייצג אלקטרוליטים.
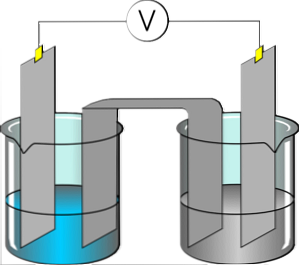
גזים מסוימים, כגון מימן כלורי, יכולים לפעול כאלקטרוליטים בתנאי טמפרטורה ולחץ מסוימים. נתרן, אשלגן, כלוריד, סידן, מגנזיום ו פוספט הם דוגמאות טובות של אלקטרוליטים.
אינדקס
- מה הם אלקטרוליטים חזקים וחלשים?
- 2 הבדלים
- 3 שיטות לזיהוי אלקטרוליטים
- 4 דוגמאות לאלקטרוליטים חזקים וחלשים
- 4.1 אלקטרוליטים חזקים
- 4.2 אלקטרוליטים חלשים
- 5 הפניות
מה הם אלקטרוליטים חזקים וחלשים?
ה אלקטרוליטים חזקים הם אלה לחלוטין מיונן - כלומר, הם 100% מופרדים - בעוד אלקטרוליטים חלשים הם מייננים רק באופן חלקי. זה אחוז של יינון הוא בדרך כלל סביב 1 עד 10%.
כדי להבדיל טוב יותר בין שני סוגים אלה של אלקטרוליטים ניתן לומר כי בתמיסה של אלקטרוליט חזק המינים העיקריים (או מינים) הם יונים וכתוצאה מכך, בעוד פתרון אלקטרוליט חלש המין העיקרי הוא המתחם עצמו. יינון.
אלקטרוליטים חזקים מחולקים לשלוש קטגוריות: חומצות חזקות, בסיסים חזקים ומלחים; בעוד אלקטרוליטים חלשים מחולקים חומצות חלשות בסיסים חלשים.
כל המרכיבים היוניים הם אלקטרוליטים חזקים, משום שהם נפרדים ליונים כאשר הם מתמוססים במים.
אפילו המרכיבים היוניים המסיסים ביותר (AgCl, PbSO4, CaCO3) הם אלקטרוליטים חזקים, כי כמויות קטנות להתמוסס במים לעשות זאת בעיקר בצורת יונים; כלומר, אין צורה או כמות מנותקת של המתחם בפתרון שנוצר.
המוליכות המקבילה של אלקטרוליטים פוחתת בטמפרטורות גבוהות יותר, אבל מתנהג בדרכים שונות בהתאם לכוחם.
אלקטרוליטים חזקים יש ירידה נמוכה יותר המוליכות שלהם בריכוזים גבוהים יותר, בעוד אלקטרוליטים חלשים יש שיעור גדול של מוליכות ירידה בריכוזים גבוהים יותר.
הבדלים
חשוב לדעת כיצד לזהות נוסחה ולהכיר באיזה סיווג זה (יון או מתחם), כי זה יהיה תלוי בסטנדרטים בטיחות בעבודה עם כימיקלים.
כאמור, אלקטרוליטים יכולים להיות מזוהים חזק או חלש בהתאם ליכולת שלהם יינון, אבל זה יכול לפעמים להיות ברור יותר ממה שהוא נראה.
רוב חומצות, בסיסים ומלחי מסיסים שאינם מייצגים חומצות או בסיסים חלשים נחשבים אלקטרוליטים חלשים.
למעשה, יש להניח כי כל המלחים הם אלקטרוליטים חזקים. לעומת זאת, חומצות חלשות ובסיסים, בנוסף לתרכובות המכילות חנקן, נחשבות לאלקטרוליטים חלשים.
שיטות לזיהוי אלקטרוליטים
ישנן שיטות כדי להקל על זיהוי אלקטרוליטים. לאחר מכן, נעשה שימוש בשיטה בת שישה שלבים:
- האם אלקטרוליט שלך הוא אחד משבעת החומצות החזקות?
- האם זה בצורת המתכת (OH)n? אז זה בסיס חזק.
- האם זה בצורת המתכת (X)n? אז זה מלח.
- האם הנוסחה שלך מתחילה עם H? אז זה כנראה חומצה חלשה.
- האם יש לה אטום חנקן? אז זה יכול להיות בסיס חלש.
- אף אחד מהנ"ל אינו חל? אז זה לא אלקטרוליט.
כמו כן, אם התגובה המוצגת על ידי אלקטרוליט נראה כמו הבאה: NaCl (s) → Na+(ac) + Cl-(AC), שבו התגובה היא תחומה על ידי תגובה ישירה (→), אנחנו מדברים על אלקטרוליט חזק. במקרה זה הוא תחם על ידי עקיף (↔) הוא אלקטרוליט חלש.
כאמור בסעיף הקודם, המוליכות של אלקטרוליט משתנה בהתאם לריכוז זה בפתרון, אך גם ערך זה תלוי בחוזק האלקטרוליט.
בריכוזים גבוהים יותר, אלקטרוליטים חזקים ואלקטרוניים לא יקטנו במרווחים משמעותיים, אך אלה חלשים יציגו ירידה גבוהה עד להגיע לערכים קרוב לאפס בריכוזים גבוהים יותר..
ישנם גם אלקטרוליטים בינוניים, שניתן לנתקם בפתרונות באחוזים גבוהים יותר (פחות מ -100%, אך גדולים מ -10%), בנוסף לאי-אלקטרוליטים, אשר פשוט אינם מנתקים (תרכובות פחמן כגון סוכרים, שומנים ואלכוהול).

דוגמאות של אלקטרוליטים חזקים וחלשים
אלקטרוליטים חזקים
חומצות חזקות:
- חומצה פרכלורית (HClO)4)
- חומצה הידרוברומית (HB)
- חומצה הידרוכלורית (HCl)
- חומצה גופרתית (H2לכן4)
- חומצה חנקתית (HNO)3)
- חומצה תקופתיים (HIO)4)
- חומצה fluoroantimonic (HSbF)6)
- חומצה קסומה (SbF)5)
- חומצה פלואורסולורית (FSO)3ח)
בסיסים חזקים
- ליתיום הידרוקסיד (LiOH)
- סודיום הידרוקסיד (NaOH)
- אשלגן הידרוקסיד (KOH)
- רובידיום הידרוקסיד (RbOH)
- Cesium hydroxide (CsOH)
- סידן הידרוקסיד (Ca (OH))2)
- סטרונציום הידרוקסיד (האב)2)
- בריום הידרוקסיד (Ba (OH)2)
- סודיום אמייד (NaNH)2)
מכירות חזקות
- נתרן כלורי (NaCl)
- אשלגן חנקתי (KNO)3)
- מגנזיום כלורי (MgCl)2)
- סודיום אצטט (CH3קונה)
אלקטרוליטים חלשים
חומצות חלשות
- חומצה אצטית (CH3COOH)
- חומצה בנזואית (C6ח5COOH)
- חומצה פורמית (HCOOH)
- ציאניד מימן (HCN)
- חומצה Chloroacetic (CH2ClOOH)
- חומצה Iodic (HIO)3)
- חומצה חנקתית (HNO)2)
- חומצה פחמנית (H2CO3)
- חומצה זרחתית (H3PO4)
- חומצה גופרתית (H2לכן3)
בסיסים חלשים ותרכובות חנקן
- דימתיליאמין (CH3)2NH)
- אתילאמין (C2ח5NH2)
- אמוניה (NH)3)
- הידרוקסילאמין (NH)2OH)
- Pyridine (C5ח5N)
- אנילין (C6ח5NH2)
הפניות
- אלקטרוליט חזק. מקור: en.wikipedia.org
- אן הלמנשטיין, פ '(s.f.). הערות מדעיות מתוך sciencenotes.org
- . (s.f.). UMass בוסטון. מאוחזר מ ocw.umb.edu
- כימיה, ד. (s.f.). מכללת סנט אולף. מתוך stolaf.edu
- אן מארי הלמנשטיין, פ '(s.f.). מחשבה. מקורו באתר Thinkco.com


