היסטוריה קלורימטר, חלקים, סוגים ומאפיינים שלהם
ה קלורימטר הוא מכשיר המשמש למדידת השינוי בטמפרטורה של כמות חומר (בדרך כלל מים) של חום ספציפי ידוע. שינוי זה בטמפרטורה נובע מהחום הנספג או המשוחרר בתהליך הנחקר; כימי אם היא תגובה, או פיזית אם זה מורכב שלב או שינוי המדינה.
במעבדה, הקלורימטר הפשוט ביותר שניתן למצוא הוא זה של כוס הקפה. הוא משמש למדוד את החום נספג או שוחרר בתגובה בלחץ מתמיד, בתמיסה מימית. התגובות נבחרות כדי למנוע התערבות של חומרים כימיים או מוצרים גזי.
 בתגובה אקסותרמית, כמות החום המשתחררת יכולה להיות מחושבת מהגידול בטמפרטורת הקלורימטר והפתרון המימי:
בתגובה אקסותרמית, כמות החום המשתחררת יכולה להיות מחושבת מהגידול בטמפרטורת הקלורימטר והפתרון המימי:
כמות החום המשתחררת בתגובה = כמות החום הנספג על ידי הקלורימטר + כמות החום הנספג על ידי הפתרון
כמות החום הנקלט על ידי הקלורימטר נקראת יכולת הקלוריות של הקלוריות. זה נקבע על ידי אספקת כמות ידוע של חום לקלורימטר עם מסה נתונה של מים. לאחר מכן, את עליית הטמפרטורה של calorimeter ואת הפתרון הוא מכיל נמדדים.
עם נתונים אלה, ואת השימוש בחום הספציפי של המים (4.18 J / g.ºC), יכולת קלורית של calorimeter ניתן לחשב. קיבולת זו נקראת גם קבוע קלורימטר.
מצד שני, החום שנצבר על ידי תמיסת מימית שווה m · CE · Δt. ב נוסחה m = מסה של מים, ce = חום ספציפי של מים Δt = וריאציה של הטמפרטורה. לדעת את כל זה, לאחר מכן ניתן לחשב את כמות החום ששוחרר על ידי התגובה אקסותרמית.
אינדקס
- 1 היסטוריה של הקלורימטר
- 2 חלקים
- 3 סוגי המאפיינים שלהם
- 3.1 כוס הקפה
- 3.2 המשאבה הקלורימטית
- 3.3 קלורימטר adiabatic
- 3.4 הקלורימטר האיזופריבי
- 3.5 קלורימטר הזרימה
- 3.6 קלורימטר לסריקת קלוריות
- 4 יישומים
- 4.1 בפיסיקוכימיה
- 4.2 במערכות ביולוגיות
- 4.3 קלורימטר של משאבת חמצן וכוח קלורי
- 5 הפניות
היסטוריה של הקלורימטר
בשנת 1780, א L. Lavoisier, כימאי צרפתי, נחשב לאחד האבות של הכימיה, השתמשו שפן ניסיונות כדי למדוד את הייצור של חום על ידי נשימתו.
איך? שימוש במכשיר הדומה לקלורימטר. החום המיוצר על ידי חזיר השפן ניכרו בהמסת השלג שהקיף את המנגנון.
חוקרים א 'L Lavoisier (1743-1794) ו P. S. Laplace (1749-1827) עיצב calorimeter ששימש למדוד את החום הספציפי של הגוף על ידי השיטה של קרח נמס.
הכדורי היה מורכב מגליל גלילי מצופה בדיל, מלוטש, מוחזק על ידי חצובה ומופסק באופן פנימי במשפך. בתוכו הונחה עוד כוס, בדומה לקודמתה, בצינור שעבר את החדר החיצוני, והוצמד לו מפתח. בתוך הכוס השנייה היתה רשת.
ברשת זו הונח הישות או האובייקט שהחום הספציפי שלו היה רצוי לקבוע. קרח הונח בתוך כלי הקונצנטריה, בדיוק כמו בסל.
החום המיוצר על ידי הגוף נספג על ידי הקרח, גורם היתוך שלה. ומוצר המים הנוזלי של ההיתוך של הקרח נאסף, פותח את מפתח הזכוכית הפנימית.
ולבסוף, כששקלנו את המים, נודעה כמות הקרח המותכת.
חלקים
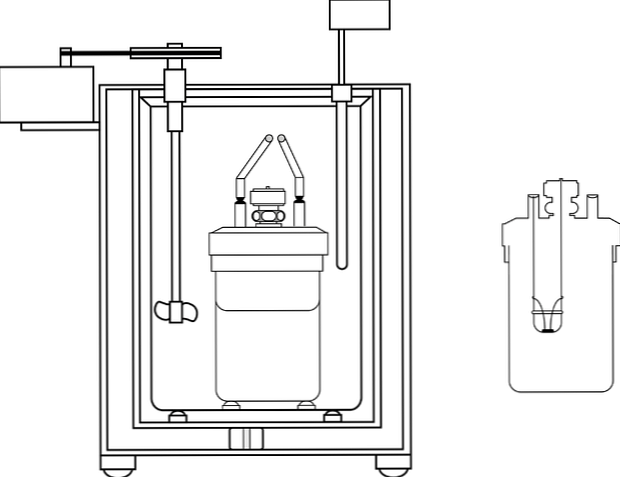
הקלורימטר הנפוץ ביותר במעבדות הוראה לכימיה הוא מה שנקרא כוס קפה קלורימטר. זה קלורימטר מורכב של כוס, או במקום זאת, מיכל של חומר אנימה כי יש תכונות בידוד מסוימים. בתוך מיכל זה הפתרון מימית ממוקם עם הגוף כי יהיה לייצר או לספוג חום.
בחלק העליון של המכולה מוצב כיסוי של חומר בידוד עם שני חורים. באחד מדחום הוא הציג למדוד את השינויים בטמפרטורה, ובשני stirrer, רצוי של חומר זכוכית, אשר מבצע את הפונקציה של העברת התוכן של הפתרון מימית.
התמונה מראה את החלקים של משאבה קלורימטריים; עם זאת, ניתן לראות כי יש לו את המדחום ואת התועמלן, אלמנטים משותפים בכמה calorimeters.
סוגי המאפיינים שלהם
כוס הקפה
זה אחד המשמש לקביעת החום שוחרר על ידי תגובה אקסותרמית, ואת החום נספג בתגובה אנדותרמית.
בנוסף, ניתן להשתמש בו בקביעת החום הספציפי של הגוף; כלומר, כמות החום שגרגר של החומר צריך לספוג כדי להעלות את הטמפרטורה שלו בדרגה אחת צלזיוס. .
המשאבה הקלורימטית
זהו התקן שבו כמות החום המשתחררת או נספגת בתגובה המתרחשת בנפח קבוע נמדדת.
התגובה מתרחשת בכלי פלדה חזק (המשאבה), אשר שקוע בכמות גדולה של מים. זה עושה את השינויים בטמפרטורת המים קטן. לכן, ההנחה היא כי השינויים הקשורים התגובה נמדדים בטמפרטורה קבועה נפח.
האמור לעיל מציין כי העבודה לא נעשה כאשר התגובה מתבצעת משאבה קלורימטרי.
התגובה מתחילה על ידי אספקת החשמל באמצעות כבלים המחוברים למשאבה.
את calorimeter adiabatic
הוא מאופיין על ידי בעל מבנה בידוד המכונה מגן. המגן ממוקם סביב התא שבו מתרחשים שינויים בחום ובטמפרטורה. הוא מחובר גם למערכת אלקטרונית ששומרת על הטמפרטורה שלה קרובה מאוד לזו של התא, כדי למנוע העברת חום.
ב קלורימטר adiabatic, ההבדל הטמפרטורה בין calorimeter וסביבתה הוא ממוזער; כמו גם למזער את מקדם העברת החום ואת הזמן עבור חילופי חום.
החלקים שלה כוללים את הדברים הבאים:
-התא (או מיכל), המשולב לתוך מערכת בידוד שבו הוא ניסה למנוע אובדן חום.
-מדחום, כדי למדוד את שינויי הטמפרטורה.
-תנור, המחובר למקור מתח חשמלי הניתן לשליטה.
-ואת המגן, כבר הוזכר.
בסוג זה של קלורימטר, מאפיינים כגון אנטרופיה, טמפרטורת Debye וצפיפות המדינה האלקטרונית ניתן לקבוע.
את calorimeter איזופריבולית
זהו מכשיר שבו תא התגובה והמשאבה שקועים במבנה הנקרא ז'קט. במקרה זה, המעיל שנקרא מורכב מים, שמרו על טמפרטורה קבועה.
הטמפרטורה של התא ואת המשאבה עולה כמו החום הוא שוחרר במהלך תהליך הבעירה; אבל הטמפרטורה של מעיל המים נשמרת בטמפרטורה קבועה.
המיקרו שולט על הטמפרטורה של התא ואת המעיל, ביצוע התיקונים הדרושים של החום דליפה הנובעת ההבדלים בין שתי הטמפרטורות.
תיקונים אלה מוחלים ברציפות, עם תיקון סופי, על בסיס המדידות לפני ואחרי הבדיקה.
זרימת קלורימטר
פותח על ידי Caliendar, יש לו מכשיר להעביר גז במיכל במהירות קבועה. בעת הוספת חום, נמדדת עליית הטמפרטורה בנוזל.
קלורימטר הזרימה מאופיין ב:
- מדידה מדויקת של קצב הזרימה המתמדת.
- מדידה מדויקת של כמות החום הציג לתוך הנוזל דרך תנור.
- מדידה מדויקת של עליית הטמפרטורה בגז הנגרמת על ידי קלט האנרגיה
- תכנון למדידת קיבולת הגז בלחץ.
קלורימטר לסריקת קלוריות
היא מאופיינת על ידי שתי מכולות: באחד המדגם להיחקר ממוקם, בעוד השני נשאר ריק או חומר התייחסות משמש.
שני הכלים מחוממים במהירות אנרגיה מתמדת, באמצעות שני תנורים עצמאיים. כאשר החימום של שתי מכולות מתחיל, המחשב יהיה גרף ההבדל של זרימת החום של תנורי נגד הטמפרטורה, ובכך להיות מסוגל לקבוע את זרימת החום.
בנוסף, ניתן לקבוע את השונות של הטמפרטורה כפונקציה של זמן; ולבסוף, היכולת הקלורית.
יישומים
בפיסיקוכימיה
-קלורימטר בסיסי, סוג כוס קפה, מאפשרים למדוד את כמות החום שגוף משחרר או סופג. הם יכולים לקבוע אם התגובה היא אקסותרמית או endothermic. בנוסף, החום הספציפי של הגוף ניתן לקבוע.
-עם calorimeter adiabatic זה היה אפשרי לקבוע את האנטרופיה של תהליך כימי ואת הצפיפות האלקטרונית של המדינה.
במערכות ביולוגיות
-Microcalorimeters משמשים כדי לחקור מערכות ביולוגיות הכוללות אינטראקציות בין מולקולות, כמו גם שינויים קונפורמטיביים מולקולריים המתרחשים; למשל, בהתפתחות המולקולה. הקו כולל הן סריקה דיפרנציאלית והן טיטרציה איזותרמית.
-Microcalorimeter משמש בפיתוח תרופות של מולקולות קטנות, biotherapeutics וחיסונים.
משאבת חמצן קלורימטר וכוח קלורי
שרפה של חומרים רבים מתרחשת ב calorimeter משאבת חמצן, ואת הכוח הקלורי שלה ניתן לקבוע. בין החומרים שנחקרו באמצעות שימוש זה קלורימטר הם: פחם וקולה; שמנים אכילים, כבדים ואור; דלק וכל דלקים מנועיים.
כמו גם את סוגי דלקים עבור כורים מטוסים; פסולת דלק וסילוק פסולת; מוצרי מזון ותוספים לתזונה אנושית; גידולי מזון ותוספי מזון לבעלי חיים; חומרי בניין; טילים ודלקי דלק.
כמו כן, הכוח הקלורי נקבע על ידי calorimetry במחקרים תרמודינמיים של חומרים דליקים; בחקר מאזן האנרגיה באקולוגיה; בחומרי נפץ ובאבקות תרמיות ובהוראת שיטות תרמודינמיות בסיסיות.
הפניות
- ויטן, דייוויס, פק & סטנלי. כימיה (8th ed.). למידה CNGAGE.
- González J., Cortés L. & Sánchez A. (s.f.). קליורימטריה אדיאבית ויישומיה. שוחזר מ: cenam.mx
- ויקיפדיה. (2018). קלורימטר. מקור: en.wikipedia.org
- הלמנשטיין, אן מארי, Ph.D. (22 ביוני 2018). הגדרה בכימיה. מקור: Thinkco.com
- ג'ילספי, קלייר. (11 באפריל 2018). איך עובד קלורימטר? Scinencing. מקור: sciencing.com


