Sarcomere מבנה וחלקים, פונקציות היסטולוגיה
א סרקומה היא היחידה הפונקציונלית הבסיסית של שריר מופשט, כלומר של שריר השלד והלב. שריר השלד הוא סוג של שריר המשמש תנועה וולונטרי שריר הלב הוא השריר כי הוא חלק מהלב.
כדי לומר כי sarcomere היא היחידה הפונקציונלית כלומר כל הרכיבים הדרושים להתכווצות כלולים sarcomere. למעשה, שרירים מופשטים מורכבים ממיליוני סרקומרים קטנים שמקצרים, באופן אינדיבידואלי, עם כל התכווצות שרירים.
הנה טמונה המטרה העיקרית של sarcomere. את sarcomeres מסוגלים ליזום תנועות גדולות על ידי התכווצות ב unison. המבנה הייחודי מאפשר ליחידות קטנות אלו לתאם את התכווצויות השרירים.
למעשה, תכונותיו השריריות של השרירים הן מאפיין מגדיר של בעלי חיים, שכן תנועת בעלי החיים היא חלקה ומורכבת להפליא. התנועה דורשת שינוי באורך השריר כפי שהוא מכופף, המחייב מבנה מולקולרי המאפשר קיצור שרירים.
אינדקס
- 1 מבנה וחלקים
- 1.1 Myofibrils
- 1.2 מיוזין ואקטין
- 1.3 מיופילמנטס
- 2 פונקציות
- 2.1 השתתפות מיוזין
- 2.2 איחוד המיאוסיין ואקטבה
- 3 היסטולוגיה
- 3.1
- 3.2 אזור ח
- 3.3
- 3.4 דיסקים
- 3.5 קו M
- 4 הפניות
מבנה וחלקים
אם רקמת שריר השלד נבדקת מקרוב, מראה מפוספס הנקרא הפשטה הוא ציין. אלה "פסים" מייצגים דפוס של להקות לסירוגין, אור כהה, המתאים חוטים חלבונים שונים. כלומר, פסים אלה נוצרים על ידי סיבי חלבון interlaced המרכיבות כל sarcomere.
Myofibrils
סיבי השריר מורכבים ממאות לאלפי איברים צמודים הנקראים myofibrils; מיופרילים אלה מסודרים במקביל ליצירת רקמת שריר. עם זאת, myofibrils עצמם הם פולימרים במהותם, כלומר, יחידות חוזרות של sarcomeres.
Myofibrils הם סיבי מבנים ארוכים, והם עשויים משני סוגים של חלבונים חלבון כי הם מוערמים על גבי אחד את השני.
מיוזין ו אקטין
מיוזין הוא סיב עבה עם ראש כדורית, אקטין הוא חוט דק יותר אשר אינטראקציה עם myosin במהלך תהליך התכווצות שרירים.
Myofibril נתון מכיל כ -10,000 sarcomeres, שכל אחד מהם הוא כ 3 מיקרומטר אורך. בעוד כל sarcomere הוא קטן, כמה sarcomeres המצרפי להאריך את אורך סיבי השריר.
מיופילמים
כל sarcomere מורכב קורות עבות, דקות של חלבונים שהוזכרו לעיל, אשר יחד נקראים myofilaments.
על ידי הרחבת חלק myofilaments, אתה יכול לזהות את המולקולות שהופכות אותם. החוטים העבים עשויים מיוזין, בעוד החוטים עדינים עשויים אקטין.
אקטין ו מיוזין הם חלבונים התכווצות הגורמות שריר קיצור כאשר הם אינטראקציה אחד עם השני. בנוסף, חוטים דקים מכילים חלבונים אחרים עם פונקציה רגולטורית הקרויה טרופונין וטרופיומוזין, המווסתים את האינטראקציה בין חלבונים קונקרטיים.
פונקציות
הפונקציה העיקרית של הסרקומה היא לאפשר לתא שריר להתכווץ. לשם כך, את sarcomere חייב להיות מקוצר בתגובה דחף עצבני.
החוטים העבים והדקים אינם מקצרים, אלא מחליקים זה את זה, מה שגורם לסרקומה לקצר בזמן שהחוטים שומרים על אותו אורך. תהליך זה ידוע כמודל של החוטים הזזה של התכווצות שרירים.
הזזה של נימה מייצר מתח שרירי, אשר ללא ספק התרומה העיקרית של sarcomere. פעולה זו מעניקה לשרירים את כוחם הגופני.
אנלוגיה מהירה זו היא הדרך בה ניתן להאריך או לקפל את הסולם הארוך בהתאם לצרכים שלנו, מבלי לקצר פיזית את חלקי המתכת.
מעורבות מיוזין
למרבה המזל, מחקרים אחרונים מציע רעיון טוב של איך זה slippage עובד. התיאוריה של נימה הזזה השתנה כדי לכלול איך myosin הוא מסוגל למשוך actin כדי לקצר את אורך sarcomere.
בתיאוריה זו, ראש הגלובוס של מיוזין ממוקם ליד actin באזור שנקרא אזור S1. אזור זה עשיר במגזרים עם צירי שיכול להיות כפוף ובכך להקל על התכווצות.
את הפלקסיה של S1 עשוי להיות המפתח להבנת איך myocin הוא מסוגל "ללכת" לאורך חוטים אקטין. זה מושג על ידי מחזורים מחייבים של קטע מיוסין S1, התכווצות שלה ואת המהדורה הסופית.
איגוד המיאוסיין ואקטבה
כאשר myocin ו actin לבוא יחד, הם יוצרים הרחבות בשם "חצו גשרים". גשרים חוצים אלה יכולים להיווצר ולשבור עם נוכחות (או היעדר) של ה- ATP, שהיא מולקולת האנרגיה שגורמת להתכווצות אפשרית.
כאשר ATP נקשר נימה actin, זה מעביר אותו למצב שחושפת האתר מחייב מיוזין שלה. זה מאפשר את הראש הגלובלית של מיוזין לצרף לאתר זה כדי ליצור את הגשר לחצות.
איחוד זה גורם לקבוצה פוספט של ה- ATP כדי לנתק, ולכן המיאוסין יוזם את תפקידה. לאחר מכן, את myosin נכנס למצב של אנרגיה נמוכה יותר שבו sarcomere ניתן לקצר.
כדי לשבור את גשר לחצות ולאפשר שוב את הכריכה של myosin כדי actin במחזור הבא, יש צורך לאגד עוד מולקולה של ATP כדי myocin. כלומר, מולקולת ה- ATP נחוצה הן לצמצום והן להרפיה.
היסטולוגיה
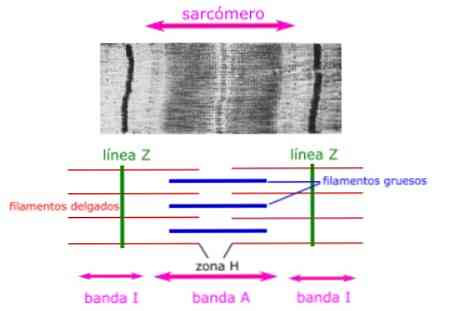
החלקים ההיסטולוגיים של השריר מראים את המאפיינים האנטומיים של הסרקומרים. החוטים העבים, המורכבים מהמיוזין, גלויים ומוצגים כלהקה של סרקומה.
חוטים דקים, המורכבים מאקטין, נקשרים לחלבון בדיסק Z (או קו Z) הנקרא alpha-actinin, והם נמצאים לאורך כל אורך הלהקה I וחלק מהלהקה A.
האזור שבו החוטים העבים והדקים חופפים יש מראה צפוף, שכן יש מקום קטן בין נימים. אזור זה שבו חוטים דקים עבים חפיפה חשוב מאוד התכווצות שרירים, שכן הוא המקום שבו התנועה של נימה מתחיל.
החוטים הדקים אינם משתרעים לחלוטין בלהקות A, ומשאירים אזור מרכזי של הלהקה A המכיל רק נימים עבים. אזור מרכזי זה של הלהקה A נראה קל יותר משאר הלהקה A, והוא נקרא אזור H.
במרכז אזור H יש קו אנכי בשם קו M, שבו חלבונים אביזר מחזיקים יחד את החוטים עבים.
להלן עיקרי המרכיבים של ההיסטולוגיה של הסרקומה:
להקה א
אזור נימה עבה, המורכב חלבונים מיוזין.
אזור ח
אזור מרכזי של הלהקה A, ללא חלבונים actin על גבי כאשר השריר הוא רגוע.
להקה אני
אזור של נימים דקים, המורכבים מחלבונים אקטין (ללא מיוסין).
Z דיסקים
האם הגבולות בין sarcomeres סמוכים, שנוצרו על ידי חלבונים אקטין מחייב בניצב sarcomere.
קו M
אזור מרכזי שנוצר על ידי חלבונים אביזר. הם ממוקמים במרכז של נימה עבה של מיוזין, בניצב סרקומה.
כפי שהוזכר לעיל, הצטמקות מתרחשת כאשר החוטים עבים להחליק לאורך החוטים בסדר ברצף מהיר לקצר את myofibrils. עם זאת, הבחנה מכרעת לזכור הוא כי myofilaments עצמם אינם חוזה; היא פעולה הזזה אשר נותן להם את כוחם לקצר או להאריך.
הפניות
- קלארק, מ. (2004). נימה הזזה ב 50. הטבע, 429(6988), 145.
- Hale, T. (2004) תרגיל פיזיולוגיה: גישה מתמטית (מהדורה ראשונה). ויילי
- Rhoades, R. & Bell, D. (2013). פיזיולוגיה רפואית: עקרונות לרפואה קלינית (מהדורה 4). ליפינקוט וויליאמס ווילקינס.
- Spudich, J. A. (2001). מיוסין מתנדנד מודל חוצה גשר. טבע ביקורות מולקולרית תא ביולוגיה, 2(5), 387-392.
- Thibodeau, P. (2013). אנטומיה ופיזיולוגיה (8)ה). מוסבי, Inc.
- Tortora, G & Derrickson, B. (2012). עקרונות האנטומיה והפיזיולוגיה (מהדורה 13). ג 'ון ויילי ובניו בע"מ.


